
В последние годы стало очевидным, что далеко не все случаи наследственной патологии у человека можно рассматривать как результат менделирующих генных мутаций, хромосомных аномалий или как мультифакториальные заболевания.
В настоящее время описано достаточно много заболеваний, которые в современной классификации наследственной патологии человека объединяют в отдельную группу: болезни с нетрадиционным типом наследования. Среди них различают: болезни импринтинга, митохондриальные болезни, болезни экспансии тринуклеотидных повторов с явлением антиципации и др.
Митохондриальные болезни.
Начиная с конца 80-х годов XX века получены убедительные доказательства связи некоторых видов наследственной патологии у человека с мутациями митохондриальной ДНК. В зависимости от типа мутаций митохондриальные болезни разделяют на 4 группы:
а) болезни, вызванные точковыми мутациями, приводящими к замене консервативных аминокислот в собственных белках митохондрий. К ним относятся пигментный ретинит и нейроофтальмопатия Лебера, при которой наступает двусторонняя потеря зрения. Выраженность клинических признаков у больных этими заболеваниями коррелирует с количеством мутантной мтДНК, которое у разных больных может варьировать от 5 до 100% всей мтДНК;
б) болезни, вызванные мутациями в генах т-РНК, приводящими к многочисленным дегенеративным заболеваниям с различной степенью тяжести клинических проявлений, коррелирующей с количеством мутантной мтДНК;
в) болезни вызванные делениями и дупликациями участков митохондриалъных генов. У человека описано тяжелое заболевание молодого и среднего возраста — отсроченная кардиопатия, при которой обнаружены делеции мтДНК кардиоцитов. Заболевание носит семейный характер. В ряде случаев предполагается Х-сцепленное наследование, что позволяет думать о существовании ядерного гена, мутация которого вызывает делению до 50% мтДНК кардиоцитов;
г) болезни, вызванные снижением числа копий мтДНК, что является следствием определенных мутаций. К данной группе относятся летальная инфантильная дыхательная недостаточность и синдром молочнокислого ацидоза, при которых число копий мтДНК снижается до 1—2% от нормы. Снижение содержания мтДНК в клетках различных органов приводит к развитию миопатий, нефропатий, печеночной недостаточности и т.д. вследствие ослабления синтеза белков, кодируемых мтДНК.
На сегодняшний день известно более 400 точковых мутаций и более сотни структурных перестроек митохондриальной ДНК (мтДНК), связанных с нейромышечными и другими митохондриальными синдромами – от летальных в неонатальном периоде до заболеваний с поздним началом. Причина возникновения и развития митохондриальных расстройств кроется, в первую очередь, в дефектах системы окислительного фосфорилирования. Отличительная особенность митохондриальных заболеваний человека состоит в их фенотипической многоликости и в феномене гетероплазмии. Существует необходимость точной оценки количества мутантных мтДНК, поскольку уровень гетероплазмии во многом определяет фенотипическое проявление заболевания. Несмотря на то, что с момента установления причинно-следственной связи между мутацией в мтДНК и определенной клинической картиной в митохондриальной биологии достигнут значительный прогресс, митохондриальные заболевания и по сей день остаются неизлечимыми и большинство врачей, сталкиваясь с такими заболеваниями, не в состоянии правильно поставить диагноз.
Что такое митохондрии и почему заболевания имеют непосредственную связь с этими структурами?
Современные митохондрии - клеточные структуры размером от 0.5 до 10 мкм, обычно вытянутой бобовидной формы. От содержимого клетки они отделены двумя мембранами, внешней и внутренней, между которыми имеется пространство. Структуру внешней мембраны полностью кодируют ядерные гены, а структуру внутренней определяет также и ДНКсамих митохондрий (мтДНК). Внешняя мембрана митохондрии гладкая, внутренняя же образует впячивания, называемые кристами. Внутри митохондрий находится матрикс — мелкодисперсное вещество, где располагаются мтДНК, рибосомы, на которых синтезируются белки, а также ферменты некоторых метаболических путей. Количество митохондрий в клетках сильно варьирует: от 1—2 тыс. в клетках печени до 200 тыс. в зрелых яйцеклетках. Митохондрии — очень динамичные структуры: они постоянно перемещаются по клетке в места наибольшего потребления энергии, при этом непрерывно сливаются и делятся, и, возможно, могут также перемещаться из одной клетки в другую. Как уже было отмечено, митохондрии содержат свою собственную ДНК (рис.2,а), в которой закодирована информация о структуре основных ферментов дыхательной цепи.
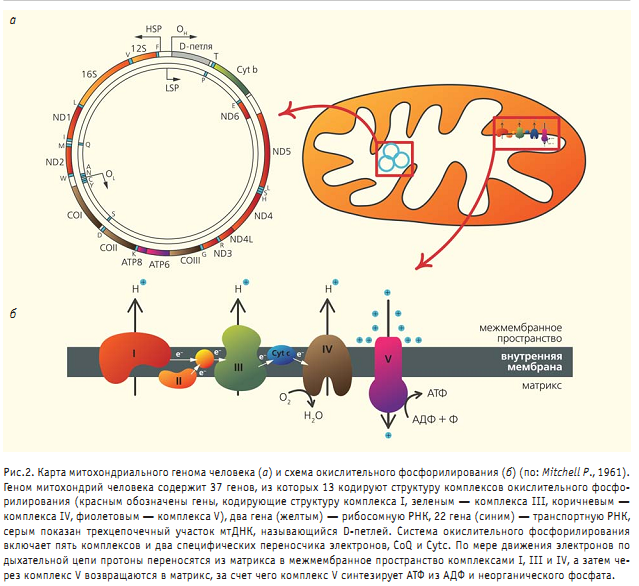
После захвата клеткой предковой митохондрии ее ДНК стала перемещаться в ядро хозяина. Постепенно поглощенная клетка теряла свою независимость, так как часть ее структуры уже определялась из ядра. Почему же не вся ДНК перешла в ядро? На этот вопрос пока нет однозначного ответа, но имеется несколько гипотез.
Одна из них гласит, что мтДНК сохранила свою независимость, поскольку имеет другой генетический код, т.е. механизм, благодаря которому записанная в ней информация определяет структуру белков.
Согласно другой, наличие в митохондриях собственной ДНК объясняется тем, что белки, кодируемые ею, крайне гидрофобны и не могут попасть в митохондрию, если синтезируются в цитоплазме.
Третья постулирует необходимость мтДНК для правильной работы комплексов окислительного фосфорилирования. Весьма оригинальную гипотезу, объясняющую, почему митохондрии сохраняют до сих пор свою собственную ДНК, выдвинул американский биохимик Д.Уоллес. Он предположил, что мтДНК — это своего рода сенсор, необходимый клетке для выживания в меняющихся условиях окружающей среды. Поскольку в мтДНК заложена информация об основных ферментах дыхательной цепи, изменение ее структуры отражается на структуре комплексов этой цепи и, соответственно, на количестве вырабатываемой энергии. Отбор тех или иных вариантов мтДНК, наилучшим образом соответствующих данным условиям обитания, служит ключевым событием для выживания клетки . Было достоверно показано действие естественного отбора на регион специфичный вариант мтДНК (гаплогруппа С), широко распространенный в арктической субарктической зоне Северо-Восточной Евразии. Основной функцией митохондрий принято считать выработку энергии в виде молекул АТФ, образующихся в ходе окислительного фосфорилирования (рис.2,б). Такой механизм получения митохондрией энергии П.Митчелл предложил еще в 1961 г., назвав его хемиосмотической гипотезой (спустя 17 лет он получил за нее Нобелевскуюпремию). Согласно этой гипотезе, специальные ферменты, находящиеся во внутренней мембране митохондрии и образующие дыхательную цепь, переносят электроны от углеводов к кислороду; одновременно некоторые из этих ферментов переносят протоны из матрикса в межмембранное пространство. В результате на внешней стороне внутренней мембраны возникает протонный градиент (повышенная концентрация протонов), который используется АТФазой — специализированным ферментом внутренней мембраны митохондрий. АТФаза активируется током протонов и синтезирует АТФ из аденозиндифосфорной кислоты (АДФ) и неорганического фосфата. Однако в ходе реакции окислительного фосфорилирования не все электроны достигают конечной цели (кислорода). Часть из них вырывается за пределы ферментов дыхательной цепи, образуя активные формы кислорода (АФК), такие как супероксид, пероксид водорода, гидроксильный радикал. Супероксид формируется главным образом в комплексах I и III. Он формируется значительно активнее при обратном транспорте электронов от сукцината к НАД+, нежели при прямом. Комплекс III в этом отношении изучен значительно лучше. Установлено, что супероксид образуется в двух сайтах комплекса III: сайт Q0 высвобождает его в межмембранное пространство, а сайт Q1 — в матрикс(основное количество супероксида выделяется именно сайтом Q0). Супероксид превращается в пероксид водорода при участии митохондриальной Mn зависимой супероксиддисмутазы, расположенной в матриксе, либо Cu Zn зависимой супероксиддисмутазы, локализованной в межмембранном пространстве митохондрий и цитоплазме клетки. Пероксид водорода, в свою очередь, превращается в воду при участии глутатионпероксидазы в матриксе либо каталазы в цитоплазме. Кроме того, в присутствии ионов Fe2+иСu2+пероксид водорода может превращаться в гидроксильный радикал. Супероксид может реагировать и с оксидом азота, который образуется эндогенно в митохондриях с помощью митохондриальной NO синтазы, приводя к образованию пероксинитрита. Установлено, что в формировании активных форм азота принимает участие комплекс IV (рис.3).
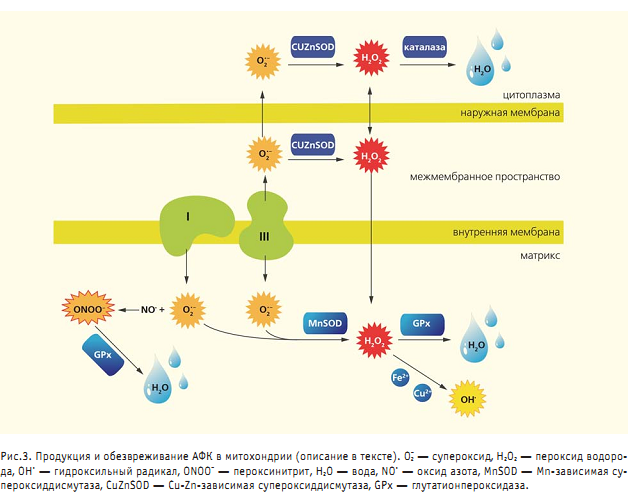
Эти крайне реакционноспособные молекулы начинают взаимодействовать со всем, что попадается им на пути, вызывая окислительные повреждения белков, липидов и нуклеиновых кислот. Кроме того, острое воздействие АФК инактивирует FeS центры ферментативных комплексов окислительного фосфорилирования и фермента цикла трикарбоновых кислот аконитазы, что снижает продукцию АТФ. Высокоактивный пероксинитрит нитрирует остатки тирозина окружающих белков, в результате чего повреждаются комплекс I и митохондриальная супероксиддисмутаза. Воздействие активных форм кислорода на мтДНК вызывает накопление мутаций, снижение скорости окислительного фосфорилирования и еще большее накопление АФК. В итоге нарушается функционирование клетки, и она погибает.
