
- •Реферат
- •Содержание
- •Глава 1. Экстракция кислот реагентами группы диантипирилметана в органические растворители (литературный обзор) 6
- •1.1. Свойства реагентов группы диантипирилметана 6
- •1.2. Закономерности экстракции кислот реагентами группы диантипирилметана в органические растворители 10
- •Глава 2.Условия проведения и техника эксперимента 28
- •2.1. Реактивы, растворы и их приготовление 28
- •2.2. Приборы 29
- •2. 3.Техника эксперимента 29
- •Глава 3. Исследование совместной экстракции хлороводородной и бензойной кислот диантипирилалканами в системе без органического растворителя 30
- •Список сокращений
- •Введение
- •Глава 1. Экстракция кислот реагентами группы диантипирилметана в органические растворители (литературный обзор)
- •1.1. Свойства реагентов группы диантипирилметана
- •1.2. Закономерности экстракции кислот реагентами группы диантипирилметана в органические растворители
- •1.2.1. Экстракция минеральных кислот
- •1.2.1.1. Экстракция фтороводородной кислоты
- •1.2.1.2. Экстракция хлороводородной кислоты
- •1.2.1.3. Экстракция других галогенводородных кислот
- •1.2.1.4. Экстракция хлорной кислоты
- •1.2.1.5. Экстракция азотной и серной кислот
- •1.2.2. Экстракция органических кислот
- •1.2.2.1. Экстракция щавелевой кислоты
- •1.2.2.2. Экстракция замещенных уксусных кислот
- •1.2.2.3. Экстракция нафталин-2-сульфокислоты из бинарных смесей
- •Глава 2.Условия проведения и техника эксперимента
- •2.1. Реактивы, растворы и их приготовление
- •2.2. Приборы
- •2. 3.Техника эксперимента
- •Глава 3. Исследование совместной экстракции хлороводородной и бензойной кислот диантипирилалканами в системе без органического растворителя
- •Список литературы
Глава 2.Условия проведения и техника эксперимента
2.1. Реактивы, растворы и их приготовление
ДАМ (ди-(1,5-диметил-2-фенил-4-пиразолин-3-он-4-ил)-метан),
ГДАМ (ди-(1,5-диметил-2-фенил-4-пиразолин-3-он-4-ил)-гептан),

где R – соответствующий углеводородный радикал.
ДАМ, С23Н24О2N4, M = 388, tпл = 178 – 179ºС;
ГДАМ, С29Н36О2N4, M = 472, tпл = 110 – 111ºС.
Синтез реагентов проводили по соответствующей реакции:

Бензойная кислота, C7H6О2, чда, М = 122, tпл = 122оС;

Хлороформ фармакопейный;
Концентрированная хлороводородная (ρ = 1, 180 г/см3) кислота. Растворы кислоты с меньшей концентрацией готовили последовательным разбавлением;
1 моль/л спиртовой раствор гидроксида натрия готовили из фиксанала;
Этанол ~ 95%.
2.2. Приборы
Магнитная мешалка MAGNETIC STIRRER Type MM4;
рН-метр МУЛЬТИТЕСТ ИПЛ-101;
2 электрода: стеклянный и хлорсеребряный.
2. 3.Техника эксперимента
Распределение кислот изучали в градуированных пробирках с притертыми пробками, помещая в них соответствующее количество органического основания, бензойной кислоты. Необходимое значение концентрации минеральной кислоты создавали введением в систему соответствующих количеств хлороводородной кислоты. Затем общий объем системы доводили до 20 мл дистиллированной водой и нагревали пробирки на водяной бане до 80ºС в течение 10-15 мин, периодически встряхивая. После нагревания пробирки охлаждали до комнатной температуры, ожидая полного просветления фаз. При этом нижняя фаза, небольшая по объему, оставалась жидкой, но вязкой.
С целью определения концентрации ионов водорода в органической фазе ее растворяли в 5-7 мл хлороформа. Этот раствор переносили в химический стакан, приливали 15 мл 70%-ного раствора этилового спирта, после чего содержимое стакана потенциометрически титровали 1 моль/л раствором NaOH.
Контроль осуществляли по содержанию кислот в водной фазе. Для этого водную фазу разбавляли до 50 мл. Брали аликвоту 5 мл в химический стакан, добавляли 15 мл 70%-ного раствора этилового спирта, после чего содержимое стакана потенциометрически титровали 1 моль/л раствором NaOH.
Глава 3. Исследование совместной экстракции хлороводородной и бензойной кислот диантипирилалканами в системе без органического растворителя
Изучена экстракция двух кислот: НСl и C6H5COOH ДАМ и его алкильным гомологом ГДАМ в расслаивающейся системе без органического растворителя.
НСl является сильной кислотой в водных растворах. Раствор концентрированной HCl представляет бесцветную, «дымящую» на воздухе, едкую жидкость. Максимальная концентрация при 20°C равна 38 % по массе, плотность такого раствора 1,19 г/см³.
C6H5COOH является слабой кислотой. В чистом виде представляет собой бесцветные кристаллы с tпл = 122,4° С, tкип = 249,2°С, tкип = 133°С при 10 мм рт. ст. Растворимость БК в различных растворителях при 25°С (грамм в 100 граммах растворителя) представлена в табл.3.1.
Таблица 3.1
Растворимость БК в различных растворителях [18]
Растворитель |
Растворимость, г/100 г растворителя |
Вода |
0,34 |
Абс. этиловый спирт |
58,4 |
Диэтиловый эфир |
40,8 |
Бензол |
12,2 |
При 370°С БК разлагается на бензол и СО2 (в небольшом количестве образуются фенол и СО). (6) Ккисл= 6.2∙10-5, рК= 4.21. [18]
Представляло интерес изучить совместную экстракцию сильной (НСl) и слабой (БК) кислот ДАМ и его гомологами в расслаивающихся системах ДАА – БК – HCl – H2O.
Первоначально изучили экстракцию НСl и БК при их совместном присутствии в зависимости от концентрации хлороводородной кислоты в водной фазе при постоянной концентрации БК (рис. 3.1).

Рис.3.1. Экстракция хлороводородной и бензойной кислот в расслаивающейся системе ДАМ – БК – НСl – Н2О (СБК = СДАМ= 0,1 моль/л; Vобщ = 20мл).
Как видно из рис. 3.1 на всем изученном диапазоне концентраций хлороводородной кислоты извлечение хлороводородной кислоты превышает извлечение бензойной кислоты и составляет максимально 75 % (при 2 моль/л НСl). Бензойная кислота максимально извлекается на 60 %. Таким образом, органическая фаза представляет собой, по видимому, смесь солей: хлорида и бензоата диантипирилметана. Причём хлоридная соль в этой фазе преобладает.
Такая высокая степень экстракции хлороводородной кислоты является преимуществом расслаивающихся систем без органического растворителя перед обычными жидкофазными экстракционными системами для образования хлоридных ацидокомплексов ионов металлов, которые и извлекаются в органическую фазу.
Кривая экстракции бензойной кислоты выходит на «плато» т.е. можно сделать вывод о том, что происходит насыщение органической фазы бензойной кислотой.
Кривая экстракции хлороводородной кислоты на постоянный уровень не выходит. Однако, концентрации ее выше 2 моль/л не пока исследовались. Это связано с трудностями дифференцированного титрования хлороводородной и бензойной кислот при совместном присутствии при высоких значениях сильной кислоты HCl.
Интересно отметить, что кривая экстракции хлороводородной кислоты имеет два четко выраженных максимума. По-видимому, один из них соответствует экстракции однохлоридной соли, другой – экстракции дихлоридной соли. Причем в органической фазе, образованной в расслаивающейся системе ДАМ – БК – НСl – Н2О, эти обе соли растворимы лучше, чем в органических растворителях. Вероятно, эти соли вместе с бензойной кислотой или с бензоатной солью диантипирилметана и образуют новую – органическую фазу в вышеназванной системе.
Также изучена совместная экстракция хлороводородной и бензойной кислот в расслаивающейся системе ГДАМ – БК – НСl – Н2О. ГДАМ является более сильным основанием по сравнению с ДАМ, поэтому можно предположить более высокую степень извлечения обеих кислот в органическую фазу.

Рис.3.2. Экстракция хлороводородной и бензойной кислот в расслаивающейся системе ГДАМ – БК – НСl – Н2О (СБК = СДАМ= 0,1 моль/л; Vобщ = 20мл).
Действительно, на рис. 3.2 видно, что максимальная экстракция БК ГДАМ составляет примерно 80 % (1 моль/л НСl). В этих же условиях наблюдается количественная экстракция соляной кислоты (примерно 100 %). При увеличении концентрации хлороводородной кислоты в водной фазе выше 1 моль/л экстракция БК немного снижается (до 50 %). А хлороводородная кислота начинает извлекаться в сверхстехиометрических количествах.
Аналогично кривой экстракции HCl, изображенной на рис.3.1, кривая экстракции хлороводородной кислоты в системе ГДАМ – БК – НСl – Н2О также имеет два максимума, причем при тех же значениях концентрации HCl. Это косвенным образом подтверждает наши предположения об извлечении хлоридной и дихлоридной соли реагента.
Дополнительно была изучена совместная экстракция вышеназванных кислот в зависимости от концентрации БК. В условиях невысоких концентраций хлороводородной кислоты (0,5 моль/л) она извлекается лучше БК практически во всём изученном диапазоне концентраций БК (рис.3.3). Максимальное извлечение БК составляет 60 % при её концентрации 0,12 моль/л. Вновь на рисунке видно, что происходит насыщение органической фазы бензойной кислотой.

Рис.3.3. Экстракция хлороводородной и бензойной кислот в расслаивающейся системе
ДАМ – БК – НСl – Н2О (СHCl = 0,5 моль/л; СДАМ= 0,1 моль/л; Vобщ = 20мл).
При более высокой концентрации хлороводородной кислоты (1,5 моль/л) зависимость экстракции каждой из исследуемых кислот становится практически линейной (рис.3.4) в интервале концентраций БК от 0,1 до 0,15 моль/л. Максимальная экстракция каждой из кислот составляет 75 – 80 %. Таким образом, в данном случае наблюдается практически одинаковая экстракция каждой из кислот.

Рис.3.4. Экстракция хлороводородной и бензойной кислот в расслаивающейся системе ДАМ – БК – НСl – Н2О (СHCl = 1,5 моль/л; СДАМ= 0,1 моль/л, Vобщ = 20мл.)

Рис. 3.5. Экстракция хлороводородной и бензойной кислот в расслаивающейся системе ГДАМ – БК – НСl – Н2О (СHCl = 0,5 моль/л; СГДАМ= 0,1 моль/л, Vобщ = 20мл.)
Как упоминалось ранее, ГДАМ является более сильным основанием. Поэтому даже при высоких концентрациях хлороводородной кислоты он лучше извлекает как хлороводородную так и бензойную кислоту по сравнению с ДАМ (рис. 3.5 – 3.7).
При всех трёх изученных концентрациях хлороводородной кислоты (0,5; 1 и 1,5 моль/л) экстракция БК монотонно увеличивается с ростом её концентрации в водной фазе, а экстракция хлороводородной кислоты снижается. Однако при значениях СНСl, равных 1 и 1,5 моль/л (рис.3.6 и 3.7) зависимость экстракции хлороводородной кислоты проходит через максимум (при 0,1 – 0,12 моль/л).

Рис. 3.6 Экстракция хлороводородной и бензойной кислот в расслаивающейся системе ГДАМ – БК – НСl – Н2О (СHCl = 1 моль/л; СГДАМ= 0,1 моль/л, Vобщ = 20мл.)
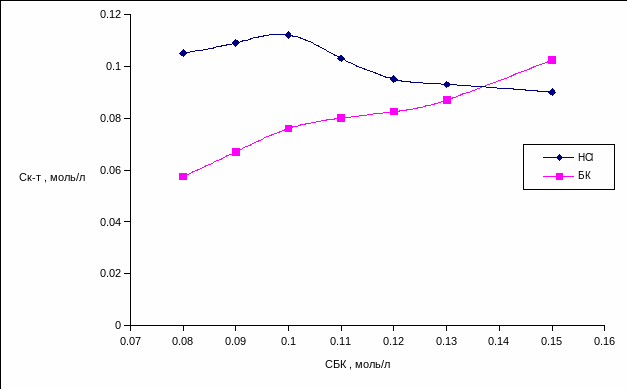
Рис.3.7. Экстракция хлороводородной и бензойной кислот в расслаивающейся системе ГДАМ – БК – НСl – Н2О (СHCl = 1,5 моль/л; СГДАМ= 0,1 моль/л, Vобщ = 20мл.)
По приведённым рисункам видно, что ДАМ и ГДАМ в сумме извлекают более одного эквивалента кислот. Можно предположить, что хлороводородная кислота связывается с ДАМ с образованием хлоридной соли, а БК извлекается в органическую фазу за счёт простого физического распределения. Для точного установления состава соединения или сольвата, образующего органическую фазу, необходимы дальнейшие исследования. Однако, уже сейчас можно предположить, что происходит образование водородной связи между ДАМ и БК или между солью ДАМ∙HCl и БК. Именно такой сложный комплекс хлоридной соли ДАМ и БК теоретически может образовывать в расслаивающихся системах ДАА – БК – НСl – Н2О органическую фазу, которая из-за ограниченной растворимости в воде вызывает ее расслаивание на две.
Выводы
1. Исследована экстракция минеральной и органической кислот при их совместном присутствии в расслаивающихся системах ДАА – БК – HCl – Н2О.
2. Показана более высокая степень извлечения хлороводородной кислоты по сравнению с бензойной кислотой. Бензойная кислота максимально извлекается гексилдиантипирилметаном (97 %) при СHCl = 1,5 моль/л и СБК = 0,15 моль/л.
3. Определена сверхстехиометрическая экстракция хлороводородной кислоты в виде двухкислотной соли реагента.
4. Предполагается образование сложного комплекса хлоридной соли ДАА и БК, который образует в расслаивающихся системах ДАА – БК – НСl – Н2О органическую фазу. Данный комплекс вследствие ограниченной его растворимости в воде вызывает ее расслаивание на две фазы.
