
- •Реферат
- •Содержание
- •Глава 1. Экстракция кислот реагентами группы диантипирилметана в органические растворители (литературный обзор) 6
- •1.1. Свойства реагентов группы диантипирилметана 6
- •1.2. Закономерности экстракции кислот реагентами группы диантипирилметана в органические растворители 10
- •Глава 2.Условия проведения и техника эксперимента 28
- •2.1. Реактивы, растворы и их приготовление 28
- •2.2. Приборы 29
- •2. 3.Техника эксперимента 29
- •Глава 3. Исследование совместной экстракции хлороводородной и бензойной кислот диантипирилалканами в системе без органического растворителя 30
- •Список сокращений
- •Введение
- •Глава 1. Экстракция кислот реагентами группы диантипирилметана в органические растворители (литературный обзор)
- •1.1. Свойства реагентов группы диантипирилметана
- •1.2. Закономерности экстракции кислот реагентами группы диантипирилметана в органические растворители
- •1.2.1. Экстракция минеральных кислот
- •1.2.1.1. Экстракция фтороводородной кислоты
- •1.2.1.2. Экстракция хлороводородной кислоты
- •1.2.1.3. Экстракция других галогенводородных кислот
- •1.2.1.4. Экстракция хлорной кислоты
- •1.2.1.5. Экстракция азотной и серной кислот
- •1.2.2. Экстракция органических кислот
- •1.2.2.1. Экстракция щавелевой кислоты
- •1.2.2.2. Экстракция замещенных уксусных кислот
- •1.2.2.3. Экстракция нафталин-2-сульфокислоты из бинарных смесей
- •Глава 2.Условия проведения и техника эксперимента
- •2.1. Реактивы, растворы и их приготовление
- •2.2. Приборы
- •2. 3.Техника эксперимента
- •Глава 3. Исследование совместной экстракции хлороводородной и бензойной кислот диантипирилалканами в системе без органического растворителя
- •Список литературы
1.2.1.3. Экстракция других галогенводородных кислот
Замена хлорид-иона на бромид-, иодид- и тиоцианат-ион повышает степень ковалентности связи RH+ ─ X- , отсюда увеличивается растворимость S солей указанных кислот в органических растворителях и уменьшается эта величина в водных растворах. В связи с увеличением отношения Sо/Sв при экстракции реагенты находятся в хлороформе независимо от кислотности водной фазы. Отношение может превышать 1 при экстракции бромоводородной кислоты, достигает 4 для тиоциановодородной и 1 для иодоводородной [12].
При фиксированной кислотности водной фазы степень превращения реагента в соль определяется силой кислоты, зарядом и размером её анионов. Когда концентрация ионов водорода в водной фазе равна 0,2 моль/л, ДАМ в растворах кислот НF, НСl, HBr, HI превращается в однозамещённую соль на 6,8; 20,2; 76,9; 99,6 %. Кислоты лучше извлекаются из растворов НХ, чем из эквивалентных смесей серной кислоты с бромидом, тиоцианатом или иодидом калия. По экстракционной способности ГДАМ превышает ДАМ. Образованием водородных связей между анионом соли и молекулой кислоты можно объяснить экстракцию бромоводородной кислоты и особенно тиоциановодородной одноимёнными солями реагентов [12].
На основании ИК-спектров экстрактов с различным содержанием тиоциановодородной кислоты сделан вывод о присоединении третьей и четвертой молекул HSCN к анионной части двухкислотной соли.
1.2.1.4. Экстракция хлорной кислоты
Среди изученных кислот хлорная кислота занимает первое место по способности экстрагироваться диантипирилметанами. В органической фазе основания превращаются в однокислотную соль при минимальной по сравнению с другими кислотами равновесной концентрации хлорной кислоты в водной фазе. Так, для ДАМ и ГДАМ она составляет соответственно 0,03 и 0,01 моль/л соответственно. Увеличение кислотности водной фазы до 2 моль/л не изменяет содержания хлорной кислоты в хлороформе. В хлороформный слой переходит не более одного эквивалента хлорной кислоты, следовательно, основания способны превращаться только в однозамещенный перхлорат [12].
По экстракционной способности, если оценивать по величине рН50 экстракцию соли R·HX, кислоты следует расположить в следующий ряд: HClO4 > HI HSCN > HBr [2].
1.2.1.5. Экстракция азотной и серной кислот
Экстракция
азотной и серной кислот изучена на
примере ДАМ, ПДАМ и ГДАМ. Как следует из
работы [13], экстракция HNO3
значительна уже при концентрации
последней в водной фазе, равной 0,25
моль/л. Сведения табл. 1.6 показывают, что
мононитрат ДАА имеет место в узком
интервале концентрации HNO3(в),
например, для ПДАМ и ГДАМ ~ 0,5 моль/л. При
дальнейшем увеличении концентрации
HNO3
в хлороформе возникает новое равновесие
между одно- и двухкислотной солями.
Константа экстракции R∙HNO3
больше для ГДАМ, а R∙2HNO3
для ДАМ, что соответствует изменению
кислотно-основных свойств реагентов
при ступенчатой протонизации. Основные
свойства ГДАМ ( = 10,50;
= 10,50;
 = 15,60) выражены сильнее, чем у ДАМ (
= 11,85;
= 14,15) [14], при первичной протонизации и
слабее при вторичной, т.е. R∙HNO3
образуется и экстрагируется в менее
кислых растворах в случае ГДАМ, а R∙2HNO3
в случае ДАМ. Начиная с 4 моль/л HNO3,
в экстракте содержится более двух
эквивалентов азотной кислоты. Экстракция
дополнительного количества HNO3
происходит, по-видимому, за счет
образования водородных связей между
анионной частью соли и молекулой кислоты.
При таком механизме экстракция третьей
молекулы HNO3
должна определяться только параметром
нуклеофильности аниона соли (NO3-)
и не будет зависеть от кислотно-основных
свойств реагентов.
= 15,60) выражены сильнее, чем у ДАМ (
= 11,85;
= 14,15) [14], при первичной протонизации и
слабее при вторичной, т.е. R∙HNO3
образуется и экстрагируется в менее
кислых растворах в случае ГДАМ, а R∙2HNO3
в случае ДАМ. Начиная с 4 моль/л HNO3,
в экстракте содержится более двух
эквивалентов азотной кислоты. Экстракция
дополнительного количества HNO3
происходит, по-видимому, за счет
образования водородных связей между
анионной частью соли и молекулой кислоты.
При таком механизме экстракция третьей
молекулы HNO3
должна определяться только параметром
нуклеофильности аниона соли (NO3-)
и не будет зависеть от кислотно-основных
свойств реагентов.
Таблица 1.6
Экстракция азотной и серной кислот растворами ДАА в хлороформе
([ДАА] = 0,1 моль/л; Vв = Vо = 20 мл) [16]
[HX](в), моль/л |
Отношение НХ:R в экстракте |
|||||||
ДАМ |
ПДАМ |
ГДАМ |
||||||
HNO3 |
H2SO4 |
HNO3 |
H2SO4 |
HNO3 |
H2SO4 |
|||
0,25 |
0,26 |
0,05 |
0,87 |
0,05 |
0,86 |
0,015 |
||
0,50 |
0,72 |
0,02 |
1,14 |
0,15 |
1,05 |
0,05 |
||
1,00 |
1,24 |
0,00 |
1,29 |
0,32 |
1,16 |
0,32 |
||
2,00 |
1,69 |
0,04 |
1,81 |
1,95 |
1,53 |
1,52 |
||
3,00 |
- |
0,16 |
- |
2,45 |
- |
2,12 |
||
4,00 |
2,44 |
0,04 |
2,40 |
2,80 |
2,01 |
2,33 |
||
6,00 |
2,77 |
- |
2,80 |
- |
2,70 |
- |
||
8,00 |
3,78 |
- |
3,65 |
- |
3,20 |
- |
||
Особенности
в распределении реагентов в системе
водный
раствор H2SO4
– хлороформ
обусловлены двухосновностью серной
кислоты. Оказалось, что ДАМ не извлекает
серную кислоту вследствие образования
труднорастворимой соли и существует в
органической фазе в форме основания.
При увеличении кислотности водной фазы
коэффициент распределения реагента
уменьшается из-за превращения последнего
в нерастворимый в хлороформе сульфат.
При концентрации серной кислоты более
4 моль/л экстракция ДАМ прекращается.
Сульфат МДАМ также плохо растворим в
хлороформе, поэтому с ростом кислотности
водной фазы содержание реагента в
органическом слое падает. МДАМ как более
сильное по сравнению с ДАМ основание
( = 11,85;
= 11,85;
 = 10,90) [14] протонируется в менее кислых
средах, что объясняет сдвиг в эту область
кривой lgDДАМ
– рН относительно аналогичной кривой
для ДАМ.
Вследствие
повышения растворимости в хлороформе
сернокислой соли ПДАМ он способен
удерживаться в органической фазе не
только в виде основания, но и в
протонированной форме. И только когда
в водной фазе создаются условия для
образования двухзарядных катионов RH2+
(> 2 моль/л H2SO4),
экстракция ПДАМ уменьшается.
= 10,90) [14] протонируется в менее кислых
средах, что объясняет сдвиг в эту область
кривой lgDДАМ
– рН относительно аналогичной кривой
для ДАМ.
Вследствие
повышения растворимости в хлороформе
сернокислой соли ПДАМ он способен
удерживаться в органической фазе не
только в виде основания, но и в
протонированной форме. И только когда
в водной фазе создаются условия для
образования двухзарядных катионов RH2+
(> 2 моль/л H2SO4),
экстракция ПДАМ уменьшается.
Ввиду ограниченной растворимости сульфатов реагентов в сернокислых растворах в системах с ДАМ, МДАМ и ПДАМ при определённой кислотности выделяется осадок. Соль ГДАМ хорошо растворяется в органических растворителях, поэтому кислотность среды практически не влияет на коэффициент распределения ГДАМ. При ее увеличении в хлороформе возрастает содержание H2SO4 и отношение [H+]o:[R]o превышает 2, начиная с водных растворов с концентрацией серной кислоты 3 моль/л.
Таким образом, гомологи ДАМ обеспечивают сверхстехиометрическую экстракцию соли вследствие большей их основности [15].
В сульфатной системе теоретически возможно образование трёх типов солей: (RH)HSO4, (RH)2HSO4, (RH2)HSO4. Энергетически более выгодна экстракция серной кислоты в виде соли (RH)HSO4,, так как на гидратацию двух однозарядных ионов затрачивается меньше энергии, чем на гидратацию двух однозарядных ионов. С ростом диэлектрической проницаемости органического растворителя, например, нитробензола, уменьшается препятствующий экстракции кислоты энергетический барьер, зависящий от разности энергий гидратации и сольватации ионов соответственно в водной и органической фазах. Это приводит к извлечению кислоты из растворов с более высокой активностью воды, иными словами к сдвигу изотерм экстракции в область более высоких значений рН. За счёт увеличения экстракционной способности реагентов становится возможной экстракция серной кислоты даже с ДАМ [12].
В предыдущих работах в большинстве случаев авторы использовали высокие концентрации кислот, что не позволяло им достаточно корректно рассчитывать константы равновесий. Для этих целей необходимо концентрацию кислот создавать не более чем 0,2 моль/л, при этом ионная сила раствора должна оставаться в одних случаях постоянной, а в других являться функцией концентрации кислоты. В качестве растворителя применяли 1,2-дихлорэтан, а концентрация ДАА составляла 0,05 моль/л.
В работе Кислицына [2] экстракция одноосновных кислот дихлорэтановым раствором ДАМ представлена уравнением
L(o) + H+(в) + A-(в) (LH)·A(o)
с концентрационной константой равновесия
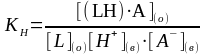 ,
,
где L – экстрагент, А – анион кислоты.
Вычисленные константы экстракции приведены в табл. 1.7. Константа экстракционного равновесия, являясь мерой экстрагируемости, обусловлена энергиями комплексообразования (GК), гидратации компонентов в водной фазе (GГ) и взаимодействия экстрагента и комплекса с разбавителем (GР) в органической [2]:
-RT lgKH = GК - GГ + GР.
Если процесс взаимодействия протона с экстрагентом в одном и том же растворителе одинаков, то величина GР изменяется незначительно. Следовательно, экстракционная способность алифатических производных антипирина определяется значениями GГ и GК [2]. Величину последнего можно оценить протонным сродством (П), определяемого как энергия диссоциации молекулы на протон и анион.
Таблица 1.7
Концентрационные константы (КН) экстракции кислот 0,05 моль/л раствором ДАМ в 1,2-дихлорэтане [2]
-
Кислота
= f(CHA)
= 0,1
= 0,2
HCl
1,18±0,5
1,49±0,18
0,72±0,05
HBr
15,60±3,30
14,70±0,90
12,00±0,30
HI
(1,24±0,28)·103
566±19·102
(1,30±0,10)·103
HNO3
94,20±14,30
67,50±3,00
57,90±1,40
HClO4
(1,17±0,16)·105
(7,00±0,39)·104
(5,35±0,51)·104
HSCN
(2,23±0,33)·103
(1,60±0,16)·103
(1,92±0,08)·103
