Подгруппа железа.
Железо и его соединения
Элементы Fe,Co,Ni образуют триаду железа, или семейство железа. Они имеют на внешнем энергетическом уровне по 2 электрона, но в образовании химических связей участвуют и электроны d-орбиталей. В устойчивых соединениях электроны проявляют степень окисления +2 и +3 и образуют оксиды RO и R2O3 и гидроксиды R(OH)2 и R(OH)3. Для них характерна особенность: присоединять нейтральные молекулы … СO, карбонилы Ni(CО)4,Co(CO)4,Fe(CO)4 используемые для получения сверхчистых металлов.
Co и Ni менее реакционноспособны, чем Fe. При об.t они устойчивы к коррозии на воздухе , в воде и различных растворах. Разбавленные HCl и концентрированная HNO3 все 3 металла пассивирует.
Me семейства железа при нагревании взаимодействуют с O2, парами воды, F2, S1, P, Si, C и B. Наиболее устойчивыми являются соединения Fe(III), CO(II) и Ni(II).
Fe, Co , Ni в ряду стандартных электродных потенциалов расположены до H, поэтому распространены в природе в виде соединений: оксиды, сульфиды, сульфаты, карбонаты; в свободном состоянии встречаются редко- в виде железных метеоритов. По распространенности в природе за Fe следует Ni, затем Co.
Fe, Co, Ni- важные материалы современной техники, но наибольшее значение имеет железо.
Строение
Fe - d-элемент VIII группы; порядковый номер – 26; атомная масса – 56.
|
1s22s22p63s23p64s23d6 |
Металл средней активности, восстановитель.
Основные степени окисления +2, +3
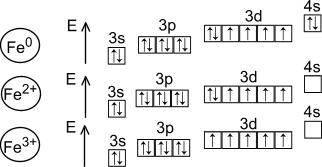
Железо, отдавая 2 внешних s-электрона и 1d-электрон c предпоследнего энергетического уровня проявляет устойчивые c/o Fe+2 и Fe+3
Fe0 - 2ē Fe+2
Fe0 - 3ē Fe+3
Физические свойства
Железо – блестящий, серебристо-белый мeталл, ρ = 7,87 г/см3, t пл. 1539○С, пластичен, легко намагничивается и размагничивается, температура Кюри 770○С – выше которого теряются магнитные свойства.
Химические свойства
Железо образует два ряда соединений.
Взаимодействие с простыми веществами
а) накаленная Fe-проволока очень ярко горит в O2, образуя окалину – оксид железа(II,III) FeO Fe2O3
Fe0-2 ē ®Fe+2 |
1 |
|
2Fe0-6 ē ®2Fe+3 |
|
|
O2+4 ē ®2O-2 |
2 |
|
|
|
|
б) при нагревании с галогенами с образованием галогенидов:
Fe0-3 ē ®Fe+3 |
2 |
Cl20+2 ē ®2Cl- |
3 |
в) взаимодействует с серой, образуя сульфид железа (II):
Fe0-2 ē ®Fe+2 |
1 |
S0+ 2ē ®S-2 |
1 |
г) при высокой t○ с углеродом, кремнием, фосфором:
3Fe+CFe3C - цементит, очень твердое серое вещество, хрупкое, тугоплавкое.
Fe0-2 ē ®Fe+2 |
|
|
2Fe0-6 ē ®2Fe+3 |
1 |
|
2H + 2 ē ®H20 |
4 |
|
|
|
|
2. Взаимодействие со сложными веществами.
a) при высокой t○ Fe реагирует с парами воды:
3Fe + 4H2O FeOFe2O3 +4H2
Этой реакцией пользуются для получения H2 при гидрировании жиров.
б) взаимодействует с разбавленными кислотами с образованием двухвалентных солей и выделением H2:
Fe + H2SO4(разб.) FeSO4 + H2
в) взаимодействует с кислотами-окислителями:
- при нагревании конц. H2SO4 взаимодействует с Fe:
Fe0-3 ē ®Fe+3 |
2 |
S+6 + 2 ē ®S+4 |
3 |
- без нагревания H2SO4 (конц.) c Fe не реагирует, так как образующаяся сульфатная пленка препятствует коррозии. При обычной t○ конц. H2SO4 перевозят в железных баках.
- разбавленная HNO3 с Fe образует NH3 или N2O и N2:
Fe0-3 ē ®Fe+3 |
8 |
N+5 + 8 ē ®N-3 |
3 |
- концентрированная азотная кислота пассивирует железо.
г) с растворами солей менее активных Me с образованием солей железа (II):
Fe + CuSO4 FeSO4 + Cu
Fe0 +Cu2+Fe+2+ + Cu0
д) во влажном воздухе железо “ржавеет”, образуя Fe(OH)3:
Fe0-3 ē ®Fe3+ |
4 |
O20 + 4 ē ®2O-2 |
3 |
е) образует комплексные соединения:
Fe0 + 5CО0 Fe(CO)5 пентакарбонил железа, используется в двигателях внутреннего сгорания для равномерной вспышки.