
- •Причина скачка потенциала на границе раздела фаз
- •Элекрохимический потенциал и равновесие на границе электрод-раствор
- •Газовые электроды.
- •10) Физические цепи (гравитационные, аллотропические).
- •Физические цепи.
- •Концентрационные цепи.
- •Химические цепи.
- •3.6) Три основных уравнения диффузионной кинетики.
- •6.6) Фазовое перенапряжение. Катодное выделение водорода и металлов.
- •Теории водородного перенапряжения.
- •6.7) Электрохимическая коррозия и способы защиты металлов от коррозии.
- •7.1) Электрические и адсорбционные явления на границе раздела фаз. Двойной электрический слой.
Газовые электроды.
Г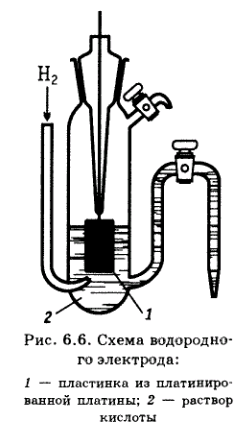 азовый
электрод представляет собой полуэлемент,
состоящий из металлического проводника,
контактирующего одновременно с
соответствующим газом и с раствором,
содержащим ионы этого газа. Всем этим
требованиям лучше всего удовлетворяет
платина, электролитически покрытая
платиновой чернью (платинированная
платина).
азовый
электрод представляет собой полуэлемент,
состоящий из металлического проводника,
контактирующего одновременно с
соответствующим газом и с раствором,
содержащим ионы этого газа. Всем этим
требованиям лучше всего удовлетворяет
платина, электролитически покрытая
платиновой чернью (платинированная
платина).
ВОДОРОДНЫЙ ЭЛЕКТРОД. Схема электрода : H+ H2 Pt
Электродная реакция : 2Н+ + 2е = Н2
![]() =
=
![]() + 2,303
+ 2,303
![]() lg
lg
![]() = 2,303
= 2,303
![]() lg
lg
![]()
2,303
lg
2,303
lg
![]()
Потенциал водородного электрода определяется не только активностью ионов Н+, но и парциальным давлением газообразного водорода
КИСЛОРОДНЫЙ ЭЛЕКТРОД. Схема электрода : ОН- О2 Pt
Электродная реакция : О2 + 2Н2О + 4е = 4ОН-
![]() =
=
![]() + 2,303
+ 2,303
![]() lg
lg
![]() =
+ 2,303
lg
=
+ 2,303
lg
![]()
2,303
lg
2,303
lg
![]()
Однако реализовать кислородный электрод на практике весьма трудно. Это обусловлено способностью кислорода окислять металлы, часть кислорода восстанавливается на электроде не до воды, а до ионов перекиси водорода.
8) Мембранные электроды, Потенциал Доннана, потенциал асимметрии, стеклянный электрод, ионселективные электроды.




 Стеклянный
электрод
Стеклянный
электрод
 Для
измерения pH растворов
можно использовать газовый водородный
электрод, но на практике для этого
обычно используют стеклянный электрод
Для
измерения pH растворов
можно использовать газовый водородный
электрод, но на практике для этого
обычно используют стеклянный электродКак правило, используют цепь
Ag|AgCl|KCl(нас.)||H+|стекло|KCl|AgCl|Ag
Для стеклянного электрода
![]()
где Eºэл – стандартный потенциал электрода; β – эмпирический параметр
Eºэл и β определяют калибровкой
Механизм действия
Мембрана проницаема для Li+ и Na+, но не H3O+
Ионы H3O+ модифицируют поверхностный слой на внутренней и внешней поверхности электродов
Степень модификации зависит от активности ионов водорода в растворе
Изменение заряда внешнего слоя передается на внутренний слой с помощью ионов Na+ и Li+, находящихся в стекле




9) Классификация Электрохимических Цепей
По источнику электрической энергии
Физические
Концентрационные
Химические
По наличию или отсутствию в цепи границы между двумя растворами
Цепи с переносом (без границы)
Цепи без переноса
10) Физические цепи (гравитационные, аллотропические).
Источник электрической энергии – различное физическое состояние одинаковых по химическому составу электродов
Электроды погружены в один и тот же раствор (цепи без переноса)
Различают
Аллотропические цепи – электроды сделаны из одного и того же металла в различных кристаллических модификациях (Mα|MA|Mβ)
Е=-дельта G\nF (энергия гиббса перехода метастабильной модификации в стабильную)
Гравитационные цепи – два жидких электрода разной высоты из одного и того же металла погружены в один раствор (Hg|Hg2I2,KI|Hg). Более высокий электрод будет растворяться.

Физические цепи.
ГРАВИТАЦИОННЫЕ ЦЕПИ. Такие цепи состоят обычно из двух жидких электродов разной высоты, изготовленных из одного и того же металла. Электроды погружены в раствор соли данного металла. Подобную цепь с ртутными электродами высотой h1 и h2 (h1 h2), опущенными в раствор соли ртути HgA, можно представить следующей схемой : Hg(h1) HgA Hg(h2)
Электрод большей высоты (h1) обладает повышенным запасом свободной энергии по сравнению с электродом менее высоким, поэтому он растворяется с образованием ионов ртути : Hg (h1) 1/2 Hg22+ + e
тогда как на правом электроде, с меньшим запасом энергии, ионы ртути разряжаются и выделяется металлическая ртуть : 1/2 Hg22+ + e Hg (h2)
Суммарный процесс в гравитационной цепи состоит, следовательно, в переносе ртути от высокого электрода к низкому : Hg (h1) Hg (h2)
АЛЛОТРОПИЧЕСКИЕ ЦЕПИ. Электродами служат две модификации одного и того же металла (М и М), погруженного в раствор или расплав его ионопроводящего соединения. При данной Т только одна из модификаций устойчива, другая находится в метастабильном состоянии. Электрод, изготовленный из металла в метастабильном состоянии (пусть это будет М), обладает повышенным запасом свободной энергии. Он играет роль отрицательного электрода элемента и посылает ионы металла в раствор : М = Мn+ + ne
На электроде, изготовленном из устойчивой -модификации, происходит разряд металлических ионов : Мn+ + ne = М
Т.о., общая реакция в аллотропической цепи М МА М заключается в переносе металла от метастабильной модификации к устойчивой :
11) Концентрационные цепи первого и второго рода. Цепи с переносом и без переноса.
Оба электрода идентичны по физическому состоянию и по химической природе; они отличаются только содержанием компонентов (концентрацией ионов, давлением газов и т.п.)
Cu|Cu2+(a1)||Cu2+(a2)|Cu
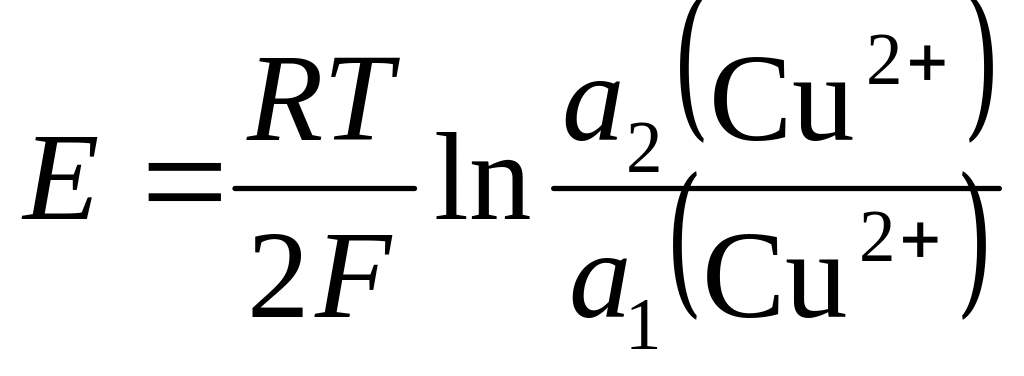
Концентрационные цепи с диффузионным потенциалом могут быть использованы для определения чисел переноса
