
- •1.1)Электрохимия
- •2.1) Электрохим. Цепь
- •3.1) Законы электролиза (законы Фарадея)
- •4.1) Кулонометры и кулонометрия
- •5.1) Представления об эл-литической диссоциации, модель гротгуса, представления фарадея.
- •7.1) Теория Аррениуса, ионные равновесия, недостатки классической теории диссоциации.
- •8.1) Энергия ионной кристаллической решетки,модельный метод борна, уравнение борна-ланде. Анализ уравнения. Константа маделунга (хлорид натрия).
- •2.1) Термодинамическое описание равновесий в растворе, связь хим. Потенциала и активности.
- •2.2) Активность и коэффициент активности электролитов. Ионная сила раствора. Распределение ионов в растворе
- •2.3) Теория электролитов дебая и гюккеля.
- •2.4) Применение теории Дебая-Хюккеля к слабым электролитам
- •2,5) Ионная ассоциация
- •2.6) Механизмы образования р-ров эл-литов, сольватация, гидратация кат, ан, м-л. Числа сольватации. Корреляционные подходы к сравнению р-лей. Их хар-ки.
- •2.7) Полиэлектролиты
- •2) Диффузия и ионов. Коэффициент диффузии. Определение, размерность, вывод первого закона Фика. Уравнение первого закона Фика для одномерной и трёхмерной диффузии.
- •4.3) Диффузионный потенциал. Уравнение для диффузионного потенциала. Эффективный коэффициент диффузии электролита. Способы устранения диффузионного потенциала.
- •7)Предельные электропроводности ионов. Формула Стокса. Правило Вальдена-Писаржевского. Формула Стокса-Эйнштейна.
- •8)Основы теории Дебая-Хюккеля-Онзагера
- •9) Эффекты Вина и Дебая-Фалькенгагена, релаксационный, элкектрофоретический.
- •10)Представления о переносе заряда в неводных растворах,ионных расплавах и твёрдых электролитах.
1.1)Электрохимия
Электрохи́мия — раздел химической науки, в котором рассматриваются системы и межфазные границы при протекании через них электрического тока, исследуются процессы в проводниках, на электродах (из металлов или полупроводников, включая графит) и в ионных проводниках (электролитах). Электрохимия исследует процессы окисления и восстановления, протекающие на пространственно-разделённых электродах, перенос ионов и электронов.
Электрохимия – раздел физической химии, который изучает системы, содержащие ионы, а также процессы и явления с участием заряженных частиц, имеющие место на границе раздела двух фаз.
Разделы электрохимии
Теория растворов электролитов
Равновесные свойства
Неравновесные явления в растворах электролитов
Термодинамика электрохимических систем
Кинетика электрохимических систем
Теория растворов – свойства однофазных систем. Э/х термодинамика и кинетика – общие условия равновесия на заряженных границах раздела фаз, строение этих границ, механизм и кинетические закономерности перехода заряженных частиц через межфазные поверхности.
Электрохимия является разделом физической химии, в котором изучаются законы взаимосвязи химических и электрических явлений. Основным предметом электрохимии являются процессы, протекающие на электродах при прохождении тока через растворы, электродные процессы.
Химическая реакция:
Контакт частиц
Малый путь электрона
Хаотичность столкновений и ненаправленность электронных переходов
Энергетические эффекты проявляются в виде теплоты
Электрохимическая реакция:
Сопровождается протеканием тока
Длинный путь электрона
Иная кинетика по сравнению с химическими реакциями
Скорость реакции зависит от потенциала на границе раздела фаз
Гетерогенны на поверхности
Перенос зарядов возможен при достаточном приближении к электроду
Большая роль границы раздела в кинетике
Пространственное разделение процессов ox & red
Направленность потоков процессов ox & red
Большую часть энергии ок-восст. Р-ции превращается в электрическую.
2.1) Электрохим. Цепь
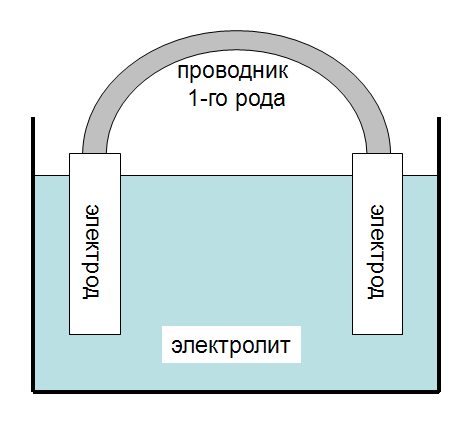
Как видно из рис. 1, для осуществления электрохимической реакции необходима некоторая система — электрохимическая цепь. Основные элементы такой цепи — металлические или полупроводниковые электроды, проводник второго рода1 (конденсированная ионная система — раствор электролита, его расплав или твердый электролит) и границы раздела фаз: между металлом или полупроводником и электролитом, между двумя различными металлами и/или полупроводниками и между двумя различными электролитами.
Электрохимические ячейки. Электрохимическая ячейка обычно состоит из двух полуэлементов, каждый из которых представляет собой электрод, погруженный в свой электролит. Электроды изготавливают из электропроводящего материала (металла или углерода), реже из полупроводника.
Полуэлементы разделяются перегородкой, которая не мешает движению ионов, но предотвращает перемешивание электролитов. Роль такой перегородки может выполнять солевой мостик, трубка с водным раствором, закрытая с обоих концов стекловатой, ионообменная мембрана, пластина из пористого стекла. Оба электрода электролитической ячейки могут быть погружены в один электролит.
Электрохимические ячейки бывают двух типов: гальванические элементы и электролитические ячейки (электролизеры).
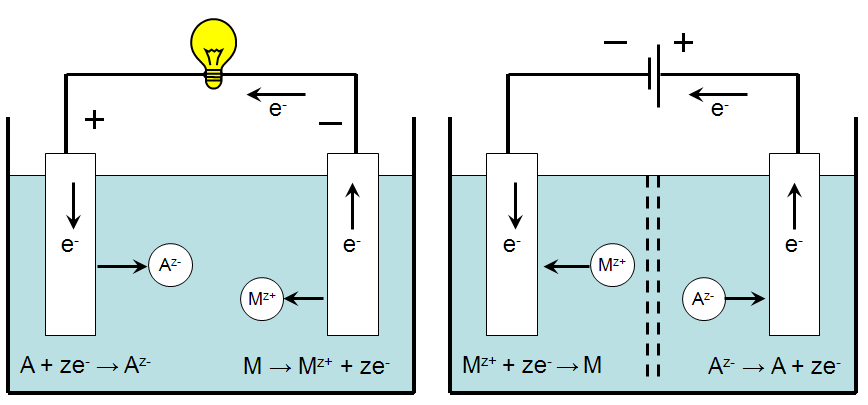

Электродный потенциал. Основные электрические параметры электрохимических ячеек - сила тока (ее измеряют в амперах, A) и потенциал (измеряемый в вольтах, В). Сила тока определяется скоростью электродных реакций, а потенциал - химической энергией протекающих в ячейке процессов. Он равен энергии (измеряемой в джоулях, Дж), отнесенной к количеству электричества (измеряемому в кулонах, Кл), т.е. 1 В = 1 Дж/Кл.
Следовательно, потенциал элемента (электродвижущая сила, ЭДС) - это мера энергии, вырабатываемой в ходе протекающих в нем реакций. Если внешняя цепь разомкнута, то никакие электродные реакции не идут.
