
- •Соли h2so4 – сульфаты
- •Получение тиосульфатов
- •1) Окисление дисульфидов кислородом
- •2) Кипячение сульфитов с порошком серы
- •Применение тиосульфата натрия Na2s2o3
- •Пниктогены
- •История открытия
- •Распространение в земной коре
- •Основные характеристики пниктогенов и их соединений
- •Азот n2 строение молекулы n2
- •Физические свойства азота
- •Химические свойства азота
- •1) При обычной температуре взаимодействует только с литием
- •Получение азота
- •Применение азота
- •Аммиак nh3 История открытия аммиака
- •Строение молекулы nh3
- •Физические свойства аммиака
- •Химические свойства аммиака
- •Получение аммиака
- •2) Гидролизом нитридов
- •Применение аммиака
Получение азота
В промышленности
Перегонкой жидкого воздуха при -190 °С
tкип(О2) = -183 °С – уже жидкий при данной температуре
tкип(N2)= -195,8 °С – все еще газообразный
При температуре -190 °С азот испаряется, а кислород остается. От примесей кислорода азот очищают, пропуская через нагретую медную сетку. Кислород связывается в CuO.
В лаборатории
1) Смешиванием растворов NH4Cl и NaNO2 при нагревании
NH4Cl + NaNO2 → NH4NO2 + NaCl
далее NH4NO2 Combin N2 + H2O
2) Окислением аммиака
NH3 + O2 → N2 + H2O
NH3 + CuO → N2 + Cu + H2O
3) Разложением азида натрия (так получают особо чистый азот)
NaN3 Combin Na + N2
4) Взаимодействием магния с очень разбавленной азотной кислотой
Mg + HNO3(разб) → Mg(NO3)2 + N2 + H2O
NH4NO2 Combin N2 + H2O
5) Разложением некоторых солей и оксидов
(NH4)2Cr2O7 Combin N2 + Cr2O3 + H2O
NH4NO2 Combin N2 + H2O
N2O Combin N2 + O2
6) Восстановлением N2O и NO
N2O + H2 → N2 + H2O
NO + C → N2 + CO2
Применение азота
1. В синтезе аммиака, который далее идет на производство азотной кислоты;
2. Создание инертной среды в органических синтезах;
3. Азотирование поверхности стальных изделий, повышающее их твердость;
4. Жидкий азот – для поддержания низкой температуры.
Аммиак nh3 История открытия аммиака
Впервые аммиак был получен в чистом виде в 1774 г. Джозефом Пристли (англ.). Он нагревал аммониак (NH4Cl) с гашеной известью (Ca(OH)2). Эту реакцию до сих пор используют в лабораториях, если требуется получить небольшие количества этого газа. Выделявшийся аммиак Пристли собирал над ртутью. Он назвал его «щелочным воздухом», т.к. водный раствор аммиака имел все признаки щелочи.
В 1784 г. французский химик Клод Луи Бертолле с помощью электрического разряда разложил аммиак на элементы и установил таким образом состав этого газа, который в 1787 получил официальное название «нашатырь» – от латинского названия нашатырной щелочи – sal ammoniac – «аммонова соль».
Название «аммиак» – это производное от старого «аммониак». В Древнем Египте жрецы храма Амон Ра для согревания ночью жгли верблюжий кизяк. При этом на стенах храма оседали белые кристаллики хлорида аммония. Это вещество получило название «аммонова соль».
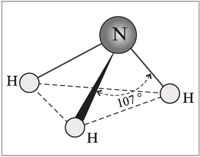
Строение молекулы nh3
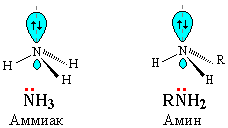
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трех атомов водорода (связи N−H):
![]()
Неподеленная пара внешних электронов строго ориентирована в пространстве, за счет чего молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
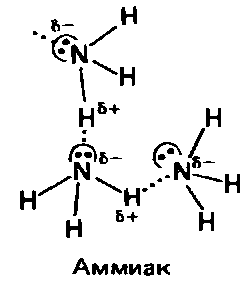
В жидком аммиаке молекулы связаны между собой водородными связями:
Физические свойства аммиака
Аммиак – бесцветный газ легче воздуха с характерным резким запахом.
tкип = -33 °С, tпл = -78 °С. Очень хорошо растворяется в воде – лучше других газов (700 V/1 V H2O при 20 °С). Это объясняется образованием прочных водородных связей между аммиаком и водой.
Жидкий аммиак (бесцветная жидкость, сильно преломляющая свет) хороший растворитель.
ЯДОВИТ! Поражает слизистые оболочки. При концентрации в воздухе 0,05 мг/л начинает проявлять раздражающее действие. У пострадавших может наблюдаться снижение слухового порога: даже не слишком громкие звуки становятся невыносимы и вызывают судороги. Смертельная доза – 150 мг/л·мин.
Взрывоопасен в смеси с воздухом. Из-за развитой системы водородных связей в жидком аммиаке при его испарении поглощается много тепла. Поэтому аммиак используют в холодильных установках.
10 %-й водный раствор аммиака – нашатырный спирт.
