
- •Московская государственная академия тонкой химической технологии
- •Общепрофессиональные дисциплины
- •Физика и химия твердого тела
- •Специальные дисциплины кристаллохимия и кристаллография
- •Физика и химия твердофазных систем
- •Специальные элективные дисциплины физико-химические основы специальных технологий Кафедра технологии полупроводниковых материалов
- •Кафедра химии и технологии наноразмерных и композиционных материалов
- •Кафедра химии и технологии редких и рассеянных элементов
- •Физико-химические основы специального материаловедения Кафедра технологии полупроводниковых материалов
- •Кафедра химии и технологии наноразмерных и композиционных материалов Физико-химические основы создания спеченных материалов
- •Физико--химические основы технологии координационных и металлоорганических соединений и Физико--химические основы технологии кластерных соединений металлов
- •Кафедра химии и технологии редких и рассеянных элементов
- •Принципы аппаратурного оформления технологических процессов Кафедра технологии полупроводниковых материалов
- •Кафедра химии и технологии наноразмерных и композиционных материалов
- •Кафедра химии и технологии редких и рассеянных элементов
Кафедра химии и технологии редких и рассеянных элементов
1. Чему равен электрохимический эквивалент меди (атомный вес - 64, валентность -2, F = 26,8 Ач)?
Ответ:
Электрохимический эквивалент металла
(ЭМ) определяют по уравнению
ЭМ=А/(nF),
где А – атомная масса элемента, F
– число Фарадея, n
– число электронов, участвующих в
электродном процессе. В соответствии
с уравнением
![]() =
1,19 г/А-ч.
=
1,19 г/А-ч.
2. Электрохимический эквивалент меди (II) равен 1,19 г/ Ач. Чему он равен для меди (I)?
Ответ:
Электрохимический эквивалент определяют
по уравнению ЭМ=А/(nF),
где А – атомная масса элемента, F –
число Фарадея, n – число электронов,
участвующих в электродном процессе.
Для электродной реакции Cu2+ + 2e =Cu
n = 2, а
=
1,19 г/А-ч, для реакции Cu+ + e =Cu n
= 1, т.е.
![]() будет в два раза больше и составит 2,38
г/А-ч.
будет в два раза больше и составит 2,38
г/А-ч.
3. Химический эквивалент меди (II) равен 32. Определите электрохимический эквивалент для нее, F = 26,8 Ач.
Ответ: Электрохимический и химический эквиваленты связаны соотношением : ЭМ= Эх/F, где F – число Фарадея (26,8 А-ч). Следовательно, для иона меди Cu2+: ЭCu= 32/26,8 = = 1,19 г/А-ч.
4. Определите последовательность выделения на катоде металлов, исходя из следующих значений Eo для систем: Cu2+/Cu = +0,34B; Au3+/Au +1,50B; Ag+/Ag +0,80B.
Ответ: Последовательность выделения металлов на катоде определяется их потенциалами: в первую очередь осаждаются более электроположительные металлы. Для приведенных металлов очередность растворения на аноде следующая: Au ® Ag ® Cu.
5. Определите последовательность растворения на аноде металлов, исходя из следующих значений Eo для систем: Zn2+/Zn –0,76B; Cu2+/Cu +0,34B; Cd2+/Cd –0,40B.
Ответ: Последовательность растворения металлов на аноде определяется их потенциалами: в первую очередь растворяются более электроотрицательные металлы. Для приведенных металлов очередность растворения на аноде следующая: Zn ® Cd ® Cu.
6. Чем определяется выход по току основного металла на катоде?
Ответ: Выход по току на катоде основного металла (hТ) зависит от следующих процессов, на которые прямо или опосредовано расходуется соответствующее количество электричества (Q):
Основной первичный электродный процесс : Mn+ + ne = M – Q1; Побочный первичный процесс: 2Н+ + е = Н2 – Q2; Побочный сопряженный с анодным процесс неполного восстановления другого иона M1, имеющего переменную валентность: M(n+m)+ + ne = M1m+ – Q3; Вторичный процесс: M + H2SO4 = MSO4 + H2 – Q4; Механические и другие косвенные потери – Q5. Тогда выход по току равен hТ = Qполезн/ Qобщ = Q1/(Q1+ Q2+ Q3+ Q4+ Q5).
7. Какие металлы и почему нельзя выделить электрохимически на катоде из водных растворов?
Ответ: На катоде нельзя выделить из водного раствора металлы, электродные потенциалы которых более электроотрицательны, чем электродный потенциал водорода с учетом его перенапряжения при выделении на соответствующем металле. Это щелочные, щелочно-земельные металлы, лантаноиды, актиноиды и другие металлы. Нельзя выделить на катоде также металлы, подверженные катодной пассивации: вольфрам, молибден, тантал, ниобий и др.
8. Чему равна составляющая баланса напряжения на электролизной ванне (EoA – EoK) при получении и рафинировании меди, исходя их следующих значений Eo для систем: Cu2+/Cu +0,34B; OH-/O2 +1,23B?
Ответ: При получении меди на электродах протекают следующие процессы, характеризуемые электродными потенциалами: К/ Cu2+ + 2e =Cu, E0Cu/Cu= +0,34В; А/ 4OH- —4e = O2 + H2O, E0OH/O=+1,23В, для которых (Е0А- Е0К)= 1,23 – 0,34 = 0,89В.
При электрорафинировании меди: К/ Cu2+ + 2e =Cu, E0Cu/Cu= +0,34В; А/ Cu – 2e =Cu2+, E0Cu/Cu= +0,34В; (Е0А – Е0К)= 0,34 – 0,34 = 0,00В.
9. При каком составе электролита величина потери напряжения на электролизной ванне (IR электролита) будет больше: а) 1M CuSO4 + 1M Na2SO4; б) 1M CuSO4 + 1M H2SO4?
Ответ: Потеря напряжения на ванне: IR = il/, где k - удельная электропроводимость раствора (ом-1см-1), l – расстояние между электродами (см), i – плотность тока (А/см2). Электропроводимость раствора 1N CuSO4 +1N H2SO4 примерно на порядок выше, чем раствора 1N CuSO4 +1N Na2SO4, т.е. величина IR потери напряжения будет меньше в случае б).
10. При каком составе электролита величина предельной катодной плотности тока больше: а) 1N CuSO4; б) 2N CuSO4?
Ответ: Предельная катодная плотность тока связана с величиной концентрации потенциалопределяющего иона соотношением iпр= кС. Т.о., для приведенного случая предельная катодная плотность тока будет больше для случая б), когда концентрация равна 2N.
11. В каком случае величина концентрационной поляризации больше: а) ik = 1 A/см2; б) ik = 2 A/см2?
Ответ: Величина концентрационной катодной поляризации (DЕК) и катодная плотность тока (iК) связаны уравнением: DЕК= ln(1 – iК/iO)×RT/nF, где R – универсальная газовая постоянная; Т – температура, К; n – число электронов, участвующих в электродной реакции; F – число Фарадея, iO- ток обмена. Для одного и того же электролита, постоянной температуры и других условий опыта все величины, кроме iК, являются постоянными. Следовательно, с увеличением iК отрицательное значение поляризации катода будет увеличиваться (под знаком ln – величина меньше единицы).
12. Назовите металлы с наибольшим и наименьшим перенапряжением выделения водорода. Можно воспользоваться справочником.
Ответ: Перенапряжение при катодном выделении водорода (смещение начала выделения водорода в отрицательную область) на разных металлах описывается уравнением Тафеля: hН/М= a + b lgiК, где a и b – постоянные величины, iК – катодная плотность тока. В «Справочнике химика» (М. – Л.: Химиздат, 1964, с.831) для 20°С приведены следующие значения:
Металл |
Pt |
Co |
Ag |
Sn |
Pb |
Раствор |
1N HCl |
1N HCl |
1N HCl |
1N HCl |
1N H2SO4 |
a |
0,10 |
0,62 |
0,95 |
1,24 |
1,56 |
b |
0,13 |
0,14 |
0,11 |
0,11 |
0,11 |
Таким образом, при iК= 1 hН/М изменяется от 0,10В в случае Pt до 1,56В в случае Pb.
13. Почему при электрохимическом получении лития используют в качестве второго компонента KCl, а не NaCl? Величины напряжения разложения хлоридов следующие: LiCl – 3,40B; KCl – 3,57B; NaCl – 3,35B.
Ответ: При катодном восстановлении металлов из хлоридных и других расплавов в первую очередь на катоде выделяются металлы, для которых напряжение разложения имеет наименьшее значение, т.е. в данном случае в следующей последовательности: Na ® Li ® K. Поскольку при получении чистого лития выделение на катоде натрия нежелательно, в качестве второго компонента при электролизе используют хлорид калия.
14. Расплавленный хлорид бериллия имеет молекулярную структуру (не проводит электрический ток). Почему в присутствии NaCl расплав становится электропроводным?
Ответ: При добавлении хлорида натрия в расплав хлористого бериллия, слабо проводящего электрический ток, протекает реакция: NaCl + BeCl2 = Na+ + [BeCl3]-, т.е. бериллий образует комплексный ион, хорошо переносящий ток при электролизе.
15. Как распределяются при электролитическом рафинировании меди примеси железа и серебра между раствором и шламом? Исходить из стандартных потенциалов Eo систем: Cu2+/Cu +0,34B; Fe2+/Fe –0,40B; Ag+/Ag +0,80B.
Ответ: При электрорафинировании металлов содержащиеся в них примеси распределяются следующим образом: более электроположительные переходят в шлам, более электротрицательные – в раствор. Т.о., согласно приведенным данным серебро будет концентрироваться в шламе, а железо накапливаться в растворе.
16. Почему при добавлении ПАВ увеличивается поляризация катода?
Ответ: Добавление ПАВ приводит к повышению катодной поляризации. Механизм действия ПАВ неоднозначен: образование сплошного адсорбционного слоя, затрудняющего прохождение ионов к катоду, блокировка (закрытие) активных центров, на которых преимущественно выделяется металл, изменение знака заряда диффузионного слоя, препятствующего прохождению через него заряженных частиц и др.
17. Цементацию ионов меди в растворе можно осуществлять, используя цинк и железо. В каком случае будет меньше остаточная концентрация меди в растворе, исходя из значений стандартных потенциалов Eo для систем: Cu2+/Cu +0,34B; Fe2+/Fe –0,40B; Zn2+/Zn –0,76B?
Ответ: При цементации меди протекает реакция: Cu2++ Zn (Fe) = Zn2+ (Fe2+) + Cu. Величина энергии Гиббса (DGp), разность электродных потенциалов (Е0) меди и цинка и их концентрации связаны уравнениями: DGp/nF= E0Zn/Zn – E0Cu/Cu = (RT/nF)ln{[Cu2+]/[Zn2+]}, что соответствует следующему:
-
Система
Cu-Zn
Cu-Fe
E0
1,10
0,78
[Cu2+]/[М2+]
10-33
10-27
Таким образом, в случае цементации меди цинком остаточная концентрация ионов меди будем меньше, чем в случае железа.
18. Объясните, чем обусловлено растворение металлов в расплаве (в электролите), укажите практическое значение этого явления.
Ответ: Растворение металлов в расплаве обусловлено:
– Реакциями, характерными для разных условий (не только для расплавов), например, Tiт + 2TiCl3ж = 3 TiCl2ж ;
– Реакциями, протекающим только в расплавах с получением соединений с пониженной степенью окисления (субсоединений), атомно-молекулярным «распылением» металла, например, Liж + Li+расплав = Li2+расплав или Cdж = Cdx, расплав, где х – число атомов, х¹0. Растворение металлов в расплаве – основная причина снижения выхода по току при электролизе в расплавах.
19. В чем отличие концентрационной поляризации от химической?
Ответ: Концентрационная и химическая поляризации имеют различную природу. В первом случае поляризация вызвана изменением концентрации потенциалопределяющих ионов вблизи поверхности электрода по отношению к концентрации в объеме, во втором это смещение потенциала по отношению к равновесному, обеспечивающее протекание с нужной скоростью процесса на поверхности электрода. Для одного и того же элемента при малых плотностях тока DЕк, конц < DЕк, хим., при больших – наоборот.
20. В какой последовательности будут восстанавливаться из раствора медь и кадмий при их цементации цинком (исходить из значений Eo для систем: Zn2+/Zn –0,76B; Cu2+/Cu +0,34B; Cd2+/Cd –0,40B).
Ответ: При цементации в первую очередь выделяются металлы, имеющие более электроположительные электродные потенциалы. Цементатором выступает металл с наиболее электроотрицательным потенциалом.
21. Объясните, что такое биполярные электроды, приведите схему их включения в электролизной ванне.
Ответ: Биполярный электрод – это электрод, на котором имеются одновременно катодные и анодные участки. Биполярные электроды используют обычно при проведении процесса рафинирования. Схемы их включения выглядят следующим образом:
–
Биполярный электрод Схема включения биполярных электродов в электролизер
22. Какие из перечисленных факторов способствуют выделению на катоде качественных (мелкокристаллических) осадков: комплексообразование в растворе; повышение (снижение) плотности тока; введение (отсутствие) ПАВ; совместное выделение металла и водорода (или отсутствие выделения водорода)?
Ответ: Качественные осадки получаются при повышенной катодной поляризации, этому способствует повышение плотности тока, наличие в растворе ПАВ, комплексных соединений. При выделении водорода металл выделяется на катоде в виде порошка.
23. Расставьте в ряд галогены в последовательности их выделения на аноде при совместном присутствии в растворе, исходя из потенциалов Eo для систем: Br-/Br2 +1,07B; Cl-/Cl2 +1,32B; I-/I2 +0,54B.
Ответ: На аноде из водного раствора выделяются вещества в порядке возрастания их электродных потенциалов, для приведенных систем это будет следующий ряд: I2 ® Br2 ® Cl2.
24. Что такое анодная оксидная пассивация металлов?
Ответ: Анодная пассивация – образование адсорбционных и фазовых окисных слоев при увеличении потенциала анода. Анодная пассивация используется для создания нерастворимых анодов и защиты металлов от коррозии.
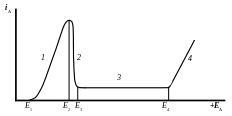
Е1 – потенциал начала растворения металла, Е2 – потенциал пассивации, Е3 – потенциал полной пассивации, Е4 – потенциал перепассивации. Кривая 1 соответствует активному растворению металла, 2 – переходу в пассивное состояние, 3 – полное пассивное состояние, 4 – протекание нового процесса: выделение кислорода или образование иона с большим зарядом (для поливалентных металлов).
25. Что такое анодная солевая пассивация?
Ответ: Солевая пассивация возникает на аноде при увеличенной плотности тока, когда в прианодном пространстве концентрации ионов превышают растворимость соответствующей соли, т.е. происходит кристаллизация соли и закрытие ею поверхности анода. Солевая пассивация – нежелательное явление, тормозящее растворение металла.
