
- •Московская государственная академия тонкой химической технологии
- •Общепрофессиональные дисциплины
- •Физика и химия твердого тела
- •Специальные дисциплины кристаллохимия и кристаллография
- •Физика и химия твердофазных систем
- •Специальные элективные дисциплины физико-химические основы специальных технологий Кафедра технологии полупроводниковых материалов
- •Кафедра химии и технологии наноразмерных и композиционных материалов
- •Кафедра химии и технологии редких и рассеянных элементов
- •Физико-химические основы специального материаловедения Кафедра технологии полупроводниковых материалов
- •Кафедра химии и технологии наноразмерных и композиционных материалов Физико-химические основы создания спеченных материалов
- •Физико--химические основы технологии координационных и металлоорганических соединений и Физико--химические основы технологии кластерных соединений металлов
- •Кафедра химии и технологии редких и рассеянных элементов
- •Принципы аппаратурного оформления технологических процессов Кафедра технологии полупроводниковых материалов
- •Кафедра химии и технологии наноразмерных и композиционных материалов
- •Кафедра химии и технологии редких и рассеянных элементов
Физико--химические основы технологии координационных и металлоорганических соединений и Физико--химические основы технологии кластерных соединений металлов
1. Перечислите основные реакции, применяемые для синтеза координационных соединений. Приведите примеры.
Ответ. Для синтеза координационных соединений используются 4 типа реакций:
1) непосредственное взаимодействие реагентов, например синтез карбонилов металлов из металлов и оксида углерода:
М + nСО = М(СО)n;
2) обмен лигандов:
[Ni(H2O)6]Cl2 + 6NH3 + H2O= [Ni (NH3)6]Cl2 + 6H2O;
3) реакции двойного обмена – реакции обмена лигандов при взаимодействии комплексов, образованных разными металлами и лигандами:
[MLn] + [M’L’n]= [ML’n] + [M’Ln];
4) окислительно-восстановительные реакции:
4СоСl2 + 4NH4Cl + 20NH3 + O2 = 4[Co(NH3)6]Cl3 + 2H2O.
2. Взаимодействие хлороформа с [Co2(CO)8] даёт соединение состава [Co3(CH)(CO)9]. ЯМР и ИК данные показывают присутствие только концевых лигандов СО и присутствие СН-группы. Предскажите структуру, согласующуюся со спектрами и корреляцией числа КВЭ со структурой.
Ответ: Количество электронов в этом кластере: 27 от трёх атомов Со, 18 от 9 групп СО, 3 от СН (один электрон использован на связь С-Н, а остальные три доступны для связи в кластере). Общее число КВЭ 48 указывает на треугольный кластер. Строение согласуется с этим выводом, присутствуют только концевые лиганды СО и вершинный СН-лиганд:
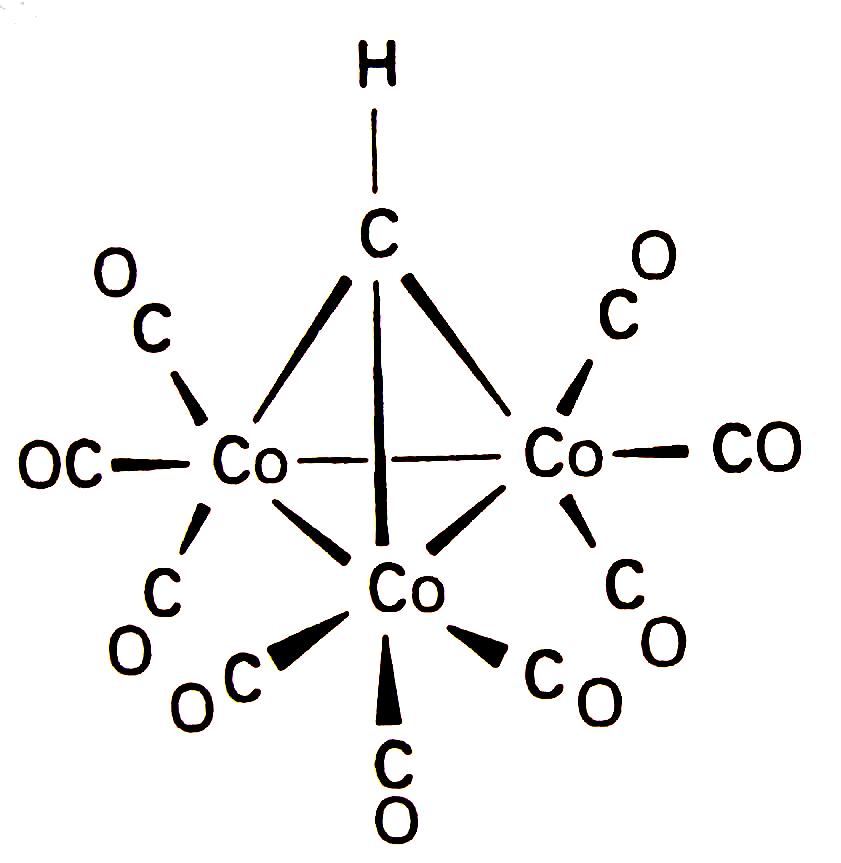
3. Опишите основные определения, термины, понятия, относящиеся к кластерам и кластерным материалам.
Ответ: Кластер – «рой, гроздь» – это такие соединения М, молекулы которых содержат окруженный лигандами остов из атомов М, расстояния между которыми допускают прямое взаимодействие М-М.
Пример: Ni6(η5-Cp)6 , содержащий 6 связанных между собой атомов Ni, к каждому из которых координирован лиганд циклопентадиенил Ср; η5 обозначает, что 5-дентатные лиганды координированы концевыми связями
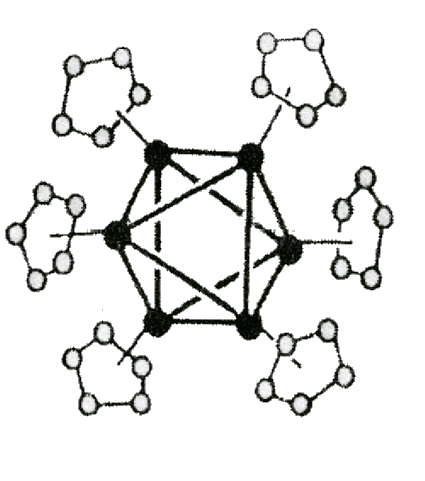
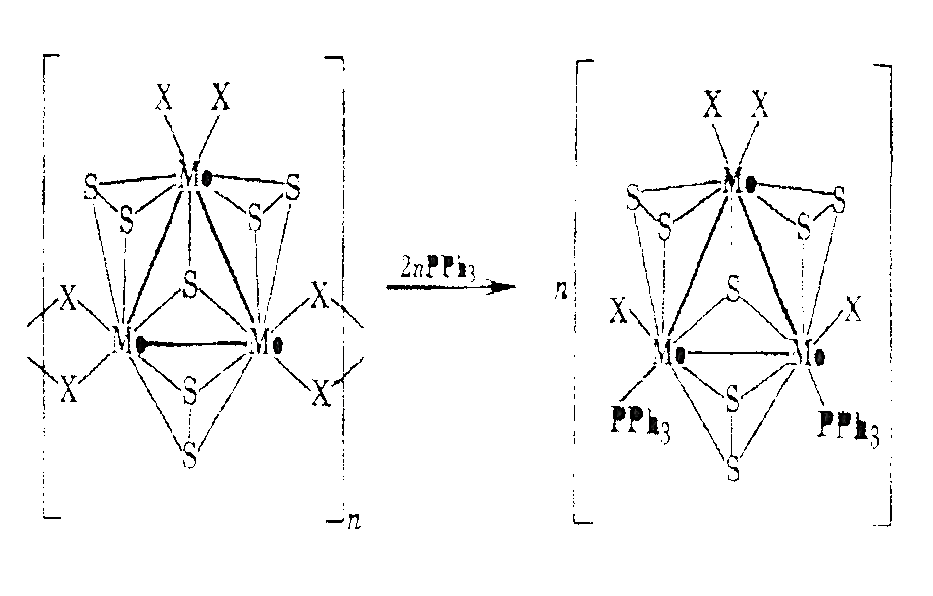
Основу кластерных материалов составляют кластеры, связанные между собой мостиковыми связями. Между кластерами и кластерными материалами существуют взаимные переходы:
Ядерность металлоостова – число атомов М в молекуле, связанных непосредственным взаимодействием М-М.
Конфигурация металлоостова – его геометрия.
Валентность – способность атома к образованию химических связей. Количественной мерой В. обычно принято считать число других атомов в молекуле, с которыми данный атом образует связи. Способность к образованию связей, а следовательно и В. атома, обусловливается не только неспаренными электронами, т.е. числом электронов, которые элемент может принять на валентную орбиталь или отдать с неё, но и неподелёнными парами и пустыми орбиталями валентной оболочки, участвующими в образовании донорно-акцепторных связей.
Дентатность – количество донорных атомов, с помощью которых лиганд связывается с одним центральным атомом.
Координационное число центрального атома – общее число нейтральных молекул и ионов (лигандов), связанных с центральным ионом. При наличии многодентатных лигандов координационное число равно произведению числа лигандов на их дентатность.
4. Опишите способы координации лигандов в кластерных соединениях и типы наиболее часто встречающихся лигандов.
Ответ: Способы координации различаются по положению на металлоостове:
- вершинная (терминальная, концевая, η-тип)
- реберная (мостиковая, μ-тип)
- граневая ( мостиковая, μ3 и μ4- тип)
- внутриполостная.
Наиболее часто встречающиеся лиганды и характерные способы их координации:
Галогены (Cl, Br, I) – вершинная (доноры 1 электрона);
– реберная (доноры 3 электронов);
– граневая (доноры 5 электронов).
Пример: Tc6(μ-Cl)6(Cl)6(μ3-Cl)23-
Сера – реберная (донор 2 электронов);
– граневая (донор 4 электронов).
Пример: Co(CO)3(μ3-S), Mo2(Cp)2(SR)2.
Карбонил (СО) – предполагает различные типы связывания: по углероду или по связи С=О. Координация может быть концевая, реберная, граневая. Во всех типах координации карбонил является донором 2 электронов.
Примеры: Mn3(Cp)(CO)3, Ni2(Cp)2(CO)2, Rh3(Cp)2(μ3-CO).
Азот и фосфор содержащие лиганды – связываются за счет свободной электронной пары на атоме азота и фосфора. Могут быть координированы по 3-м типам связывания: концевой, граневой, реберной.
Примеры лигандов: амины (NR3) – монодентатные лиганды; амиды (NR2-) – мостиковая координация; имиды (NR2-) – μ- и μ3- координация.
5. Опишите методы определения молекулярной массы кластеров.
Ответ: Молекулярная масса – очень важный параметр кластера, поскольку позволяет определить его ядерность.
Метод эбуллиоскопии основан на понижении температуры кипения раствора, содержащего анализируемое вещество, по сравнению с чистым растворителем в зависимости от количества находящихся в растворе частиц, т.е. от мольной доли растворенного вещества.
Метод криоскопии основан на понижении температуры замерзания раствора по сравнению с температурой замерзания чистого растворителя.
Недостаток обоих методов: для анализа необходимо большое количество вещества, применим для кластеров с небольшими массами.
Масс-спектрометрический метод (МС) основан на разделении в вакууме под действием электрического и магнитного полей ионов с различным соотношением массы к заряду.
Методы МС различаются по способу ионизации анализируемого соединения.
Простейший метод – метод электронного удара – ионизация вещества происходит за счет «выбивания» электрона с оболочки атома внешним электроном. Метод применим только для легколетучих соединений.
Химическая ионизация – применима для нелетучих соединений.
Бомбардировка быстрыми атомами (FAB) – мягкий метод ионизации, применим для нелетучих соединений, вещество берется в матрице.
Ионизация электрическим полем (FI) – мягкий метод ионизации для нелетучих соединений.
Ионизация лазерным импульсом (LDI) – мягкий метод ионизации, применим для нелетучих соединений.
MALDI – вариант LDI с предварительным замораживанием образца в инертной матрице.
Электрораспыление (ES) – мягкий метод ионизации, применим для нелетучих соединений.
6. Дайте определение понятиям «дентатность», «амбидентатность», «координационное число», «координационный полиэдр». Приведите примеры.
Ответ. 1) Дентантность – это количество донорных атомов, с помощью которых лиганд связывается с одним центральным атомом. Например, K[Au(CN)2]: лиганд CN- связан с золотом(I) одним атомом углерода и потому является монодентантным. В [Au(CN)2(bpy)] бипиридин является бидентантным лигандом, т. к. координируется с атомом золота (III) двумя атомами азота.
2) Амбидентатность – это способность лигандов, содержащих два или более донорных атома, присоединяться к центральному атому разными способами, т.е. это конкурентная координация. Например, тиоционатный лиганд NCS- имеет три донорных атома – N,C,S. Поэтому он способен координироваться с металлами десятью разными способами.
3) Координационное число – это количество донорных атомов, с помощью которых лиганды непосредственно связаны с центральным атомом.
K[Au(CN)2] – координационное число золота (I) - 2
[Au(CN)2(bpy)] – к.ч. золота (III) - 4
K3[CoF6] – к.ч. Co (III) - 6
[Cu(SCN)2(NH3)4] - к.ч. Cu (II) – 6
4) Координационный полиэдр – это геометрическая фигура (многогранник), определяющий пространственное расположение донорных атомов лигандов вокруг центрального атома. Количество вершин полиэдра равно координационному числу.
K3[CoF6] – к.ч. Co (III) – 6, форма координационного полиэдра – октаэдр;
[Cu(SCN)2(NH3)4] - к.ч. Cu (II) – 6, форма координационного полиэдра – тетрагональная бипирамида.
7. Опишите «правило 18- электронной конфигурации» и проиллюстрируйте его на примере карбонилов металлов d- элементов. Рассмотрите применение этого правила на примере соединения HFеСо3(СО)9[P(OCH3)3]3
Ответ. Правило 18 электронов было предложено Сиджвиком в начале 20 века как условие устойчивости атома металла в координационном соединении. Поскольку 18 электронов имеет благородный газ, завершающий длинный период, в котором находится данный d- элемент, то, следовательно, координационное соединение, в котором металл имеет 18-электронное окружение, будет наиболее устойчиво. Следовательно, атомы металла, взаимодействуя с лигандами и друг с другом, дополняют свою внешнюю электронную оболочку до 18.
При подсчете электронов все атомы металлов и лигандов считаются нейтральными. Если комплекс заряжен, просто добавляют или вычитают соответствующее число электронов из общего числа. Учитывают все валентные электроны атома металла и все электроны, поставляемые лигандами.
Примеры:
Fe(CO)5 – 8 e- от атома Fe (т.к. железо находится в VIII-группе) и 10 e- от пяти лигандов СО (по 2 e- от каждой СО- группировки);
Cr(CO)6 - 6 e- от атома Cr (VI-группа) и 12 e- от шести лигандов СО;
Co2(CO)8 - 9 e- от атома Cо, 8 e- от четырех лигандов СО и 1 e- от связи Ме-Ме.
Правило 18-электронной оболочки позволяет рассчитывать число связей металл-металл. Подсчет электронов производится следующим образом. Для кластерного соединения с общей формулой MmLn (L – для простоты двухэлектронный лиганд) общее число электронов равно vm+2n, где v - число валентных электронов данного металла М. Число связей металл-металл (Х) определяется по формуле
Х =[18m-(vm+2n)]/2
Пример: Кластерное соединение HFеСо3(СО)9[P(OCH3)3]3 имеет
(vm+ 2n) = 8(Fe) + 3х9(Со) + 1 (Н) + 9х2(СО) + 3х2(Р) = 60 кластерных валентных электронов (КВЭ); соответственно Х = (18x4- 60)/2 = 6, т. е. на один атом железа и три атома кобальта должно быть шесть связей металл-металл, что характерно дня тетраэдра.
8. Какие бывают группы кластеров и какие молекулы относятся к этим группам?
Ответ: Кластеры бывают малые, большие и гигантские.
Малые кластеры: к этой группе относятся молекулы с числом атомов металла от 3 до 12. Характерная особенность этой группы кластеров заключается в том, что все атомы металлов лежат на поверхности кластера, все они доступны взаимодействию с субстратами извне (если этому взаимодействию не мешают лиганды).
N= 3 – треугольник, N = 4 – тетраэдр, N=5 - тригональная бипирамида, N = 6 - октаэдр.
Большие кластеры – кластеры с числом атомов металла от 13 до 150 (размер металлоостова от 8 до 20 Ǻ). В отличие от предыдущей группы здесь реализуется упаковка, при которой возникают как внутренние, так и поверхностные атомы металлов. В этой группе кластеров обязательным является преобладание поверхностных атомов металла в металлоостове, т.е. в них всегда сохраняется соотношение Мпов/Мвн > 1.
Гигантские кластеры имеют многослойный металлоостов, в котором число поверхностных атомов металла меньше числа внутренних атомов металла, т.е. в них всегда реализуется соотношение Мпов/Мвн <1. Металлоостовы этих соединений имеют сферическую или близкую к ней форму с диаметром от 20 до 100 Ǻ.
Частицы еще больших размеров – это уже коллоидные частицы.
9. Опишите важнейшие лиганды, наиболее часто встречающиеся в химии кластеров, число электронов, донирумых такими лигандами для образования связей, и способы их координации.
Ответ: Наиболее распространены следующие лиганды:
- Водород - в виде гидрид-иона Н- - всегда является донором одного электрона. Способы координации (практически все) – вершинная, реберная, граневая, внутриполостная.
- Галогены (CI, Вг, I) - могут иметь вершинную, реберную и граневую координацию. В первом случае они являются донорами 1 электрона, во втором - 3 электронов, и в третьем - 5 электронов (при µ3_координации).
- Сера - в виде атома S - может иметь реберную (мостиковую, µ-типа) или граневую (мостиковую, µ3-типа координацию). При реберной координации (µ-S) атом серы является донором 2 злектронов, а при граневой (µ3-S) координации - донором 4 электронов.
- Карбонил (СО) - довольно часто встречающийся лиганд. Наличие в молекуле лиганда двух донорных атомов, связанных между собой кратной связью, предполагает возможность различных типов его координации - и по атому С, и по атому О, и обоими атомами одновременно. Однако в реальности в подавляющем большинстве случаев реализуется координация только по атому углерода, иногда встречается координация по обоим атомам одновременно, а координация только по атому кислорода на сегодняшний день не описана.
- Моноолефин в моноядерных соединениях может координироваться по σ- и π-типу. Молекула олефина, взаимодействующая с трехъядерной системой, является донором четырех электронов: по одному электрону подается для образования каждой из двух σ-связей С-М, два электрона от связи с=с на третий атом металла. При этом каждый из отщепляющихся от олефина атомов водорода становится в кластере гидридным мостиком и дает по одному электрону.
- Азот- и фосфорсодержащие лиганды – монодентатные триалкил- или триарилфосфины донируют на образование связи 2 электрона. Бидентатные фосфины являются донорами 4 электронов – по одной паре от каждого атома фосфора.
10. Для чего используется описание электронного строения кластеров и что лежит в основе двух известных подходов к описанию?
Ответ: Описание электронного строения кластеров необходимо для получения МО сложной молекулы на основании данных об энергиях и форме МО отдельных фрагментов. В этой связи главный вопрос - как выделить те фрагменты сложной молекулы, симметрия которых в максимальной степени отражает симметрию всей молекулы, а взаимодействие граничных орбиталей наиболее важно для определения устойчивости системы в целом.
В настоящее время разработаны и применяются два подхода к описанию электронного строения кластеров, исходя из указанных позиций.
Первый подход: молекулу кластерного соединения MmLn псевдосферической симметрии разбивают на сферическое ядро (металлоостов) и лигандную шубу; МО кластера получают, комбинируя «внешние» МО металлического ядра с подходящими по симметрии МО лигандной сферы:
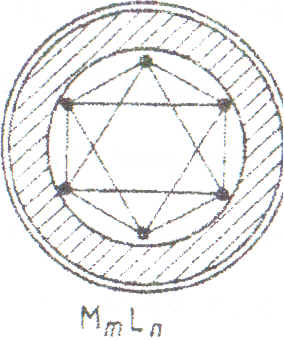
Дальнейшее обсуждение (выводы из этого подхода для данной картинки)
Второй подход заключается в разделении псевдосферической кластерной молекулы на одинаковые фрагменты MLq
Иллюстрация?
