
- •3.Опыты по рассеиванию -частиц: схема опыта, сущность и особенности эксперимента, значение.
- •8. Обобщённая формула Бальмера: формула, физический смысл.
- •11) Первый постулат Бо8/ра (постулат о стационарных состояниях): формулировка, диаграмма энергетических уровней.
- •12.Второй постулат Бора (условие частот): формулировка, формула, диаграмма энергетических уровней.
- •14. Доказательство дискретности значений энергии атома: опыт Франка и Герца.
- •15. Значение и недостатки теории Бора.
- •16. Предпосылки создания гипотезы Луи де Бройля.
- •17. Физическая сущность и формулировка гипотезы де Бройля.
- •18. Записать и пояснить физический смысл волновой функции.
- •19. Вывести выражение, определяющее длину волны де Бройля – д.
- •20. Как де Бройль обосновал правило квантования момента импульса в третьем постулате Бора?
- •21. Найдите зависимость длины волны электрона от ускоряющего напряжения электрического поля, в котором он находится.
- •22. Физические основы явления дифракции электронов в опытах к. Дэвиссона и л.Джермера (схема установки, выводы).
- •23. Анализ графика зависимости количества отражающихся от монокристалла электронов от их скорости движения.
- •24. Сравнительный анализ электронограммы в опытах по дифракции электронов с дифракционной картиной рентгеновских лучей.
- •25. Запись и анализ формулы для определения длины волны в опытах к. Дэвиссона и л.Джермера.
- •26. Применение дифракции частиц в медицине, фармации, технических приборах.
- •27.Устройство и принцип действия магнитной линзы
- •28.Устройство и принцип действия растрового электронного микроскопа.
- •29. Благодаря чему разрешающая способность электронного микроскопа выше, чем у оптического?
- •30. Как проявляются волновые свойства атомов и ионов?
- •31. Статистическая интерпретация волн де Бройля.
- •36.С оотношения неопределённостей
- •37. Физический смысл соотношений неопределённостей.
- •38. Какой смысл имеют величины, входящие в формулу е t h
- •40. Какое состояние называют стационарным, квазистационарным?
- •41. Как можно измерить среднее время жизни квазистационарного состояния атома?
- •42. Получите основное уравнение квантовой механики (уравнение Шрёдингера) для стационарных состояний?
- •47. Объясните, почему энергетический спектр для прямоугольной потенциальной ямы дискретен, я число уровней конечно.
- •49. Сравните поведение классической и квантово-механической частиц в потенциальной яме.
- •53. Перечислите основные положения, используемые при вычислении спектра гармонического осциллятора методом Шрёдингера
8. Обобщённая формула Бальмера: формула, физический смысл.



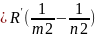
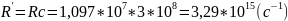


Где T(m) и T(n) некоторые функции, зависящие от номера m,n и называются спектральные термы. => Они представляют собой функции от целых чисел m и n и определяют границы частот для соответствующих спектр.серий
9.Роль и значение открытия Ридберга, понятие о спектральных термах и их физический смысл.
Первый
начал оперировать волновым числом.
Показал, что расположение линий в атомных
эмиссионных спектрах может быть описано
формулами, аналогичными формуле И. Бальмерадля
спектра водорода. Ввёл универсальную
константу R (постоянная
Ридберга),
установил связи между различными
сериями, образующими спектр элемента,
дал формулу, описывающую любую спектральную
линию.
![]()
где
![]() —
длина
волны электромагнитного излучения,
испущенного в вакуум,
—
длина
волны электромагнитного излучения,
испущенного в вакуум,
![]() — постоянная
Ридберга,
— постоянная
Ридберга,
![]() и
и ![]() —
целые числа, такие, что
—
целые числа, такие, что ![]() .
.
Принимая равным 1, и полагая, что может принимать целые значения от 2 до бесконечности, получаем спектральные линии, известные как серия Лаймана, нижняя граница длин волн которых стремится к 91 нм.
Спектральный терм - конфигурация (состояние) электронной подсистемы, определяющая энергетический уровень. Иногда под словом терм понимают собственно энергию данного уровня. Переходы между термами определяют спектры испускания и поглощения электромагнитного излучения.
10.Значение гипотезы Планка в теории Бора.
Бор
применил квантовую гипотезу Планка к
модели Резерфорда и доказал, что если
атом может изменять свою энергию только
прерывно, атом существует лишь в
дискретных стационарных состояниях.
Низшее из этих состояний и есть нормальное
состояние для атома.
H=6,626*
11) Первый постулат Бо8/ра (постулат о стационарных состояниях): формулировка, диаграмма энергетических уровней.
Атомы или атомные системы сколь угодно долго могут находиться только в определённых состояниях, называемых стационарными (не зависящими от времени), если извне они не получают дополнительную энергию. В стационарном состоянии атом не излучает и не поглощает энергию, ему соответствует определённое значение энергии Еn.
 Рисунок:
Энергетические уровни атома и условное
изображение процессов поглощения и
испускания фотонов.
Рисунок:
Энергетические уровни атома и условное
изображение процессов поглощения и
испускания фотонов.
12.Второй постулат Бора (условие частот): формулировка, формула, диаграмма энергетических уровней.
При переходе атома из одного стационарного состояния с энергией En в другое стационарное состояние с энергией Em излучается или поглощается квант, энергия которого равна разности энергий стационарных состояний:
|
Если n>m, то излучение(∆E2`=E3-E1); если n<m, то поглощение кванта (∆E1=E1-E2).
E, эВ
E∞

E
 3
3
E
 2
2
E1
(Рядом со стрелками надписи слева направо: около первой - (1); около второй - (2); около третьей -(1`); около четвёртой - (2`))
13- Третий постулат Бора (для больших квантовых чисел): формулировка, формула, физический смысл постулата.
Электрон
в атоме, не теряя энергии, двигается по
определённым дискретным круговым
орбитам, для которых момент импульса
квантуется:
![]() ,
где
,
где
![]() —
натуральные числа, а
—
натуральные числа, а
![]() —
постоянная Планка. Пребывание электрона
на орбите определяет энергию этих
стационарных состояний.
—
постоянная Планка. Пребывание электрона
на орбите определяет энергию этих
стационарных состояний.
Т.е. момент импульса электрона кратен постоянной Планка
