
- •Державний вищий навчальний заклад
- •Міністерства освіти і науки України колоїдна хімія
- •Поверхневі явища й адсорбція
- •Адсорбція на межі "рідина - газ", "рідина - рідина"
- •Розрахунок параметрів адсорбційного шару
- •Закономірності адсорбції на поверхні твердих адсорбентів
- •Приклади розв’язку задач.
- •Задачі для самостійного рішення
- •2. Дисперсні системи та їх властивості
- •2.1. Загальна характеристика дисперсних систем
- •Класифікація дисперсних систем
- •Класифікація дисперсних систем за взаємодією дисперсної фази і дисперсійного середовища
- •Одержання і очищення колоїдних розчинів
- •2.2. Електрокінетичні явища в колоїдних розчинах
- •Коагуляція колоїдних систем
- •Властивості розчинів поліелектролітів
- •Застосування електрофорезу та електроосмосу
- •2.3. Мікрогетерогенні та грубодисперсні системи Загальна характеристика мікро гетерогенних та грубодисперсних систем
- •Суспензії
- •Емульсії
- •Аерозолі
- •Порошки
- •Приклади розв’язку задач.
- •Задачі для самостійного рішення.
- •Молекулярно-кінетичні властивості колоїдних систем
- •Броунівський рух
- •Осмотичний тиск
- •Седиментаційно-дифузійна рівновага
- •Приклади розв'язування задач
- •Задачі для самостійного розв'язування
- •Оптичні властивості колоїдних систем
- •Забарвлення колоїдних систем
- •Приклади розв'язування задач
- •Задачі для самостійного розв'язування
- •5. Розчини високомолекулярних сполук
- •Визначення молекулярних мас полімерів
- •Осмометричний метод
- •Віскозиметричний метод
- •Висолювання полімерів з розчинів
- •Набухання полімерів
- •Фізичні стани полімерів
- •Ділянка іі - високоеластичний стан; ділянка ііі - в'язкотекучий стан.
- •Напівколоїди Властивості розчинів напівколоїдів
- •Механізм утворення міцел.
- •Миюча дія мил
- •Структурно-механічні властивості зв'язанодисперсних систем
- •Приклади розв'язування задач
- •Теоретичні питання до контрольної роботи
- •Література
- •Колоїдна хімія
- •Навчально-методичне видання
- •Коваленко Данило Сергійович колоїдна хімія
- •Рецензент б.П. Зоря
Коагуляція колоїдних систем
Наявність подвійного електричного шару на поверхні частинок забезпечує їх стабільність (стійкість). При зближенні двох колоїдних частинок їх дифузійні шари перекриваються, що призводить до відштовхування частинок, внаслідок чого вони не злипаються. Чим більша товщина дифузійної частини ПЕШ та більше значення ξ -потенціалу, тим вища стійкість системи. Товщина дифузійного шару частинки зменшується з підвищенням концентрації індиферентного електроліту в системі. Коли товщина дифузійного шару дорівнює нулю, всі протиіони розміщуються в адсорбційному шарі. При цьому ξ = 0 і спостерігається ізоелектричний стан (гранули електронейтральні). Система миттєво коагулює.
Процес концентраційної коагуляції характеризує рис.13.
Крім концентраційної, існує нейтралізаційна коагуляція. При нейтралізаційній коагуляції іони електроліту нейтралізують потенціалвизначальні іони. При цьому зменшується поверхневий потенціал і, відповідно, ξ -потенціал. У порівнянні з ліофобними золями, ліофільні золі термодинамічно стійкі. Якщо для коагуляції гідрофобного золю потрібна незначна кількість електроліту, то для коагуляції ліофільного золю (руйнування сольватної оболонки) - кілька молей на літр.
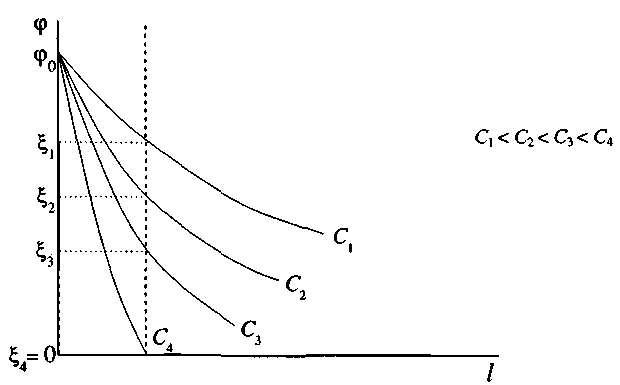
Рис.14. Вплив концентрації індиферентного електроліту на будову ПЕШ і величину ξ-потенціалу.
Прикладом коагуляційних процесів є процеси, які протікають у річкових водах при змішуванні їх з морською водою. Коагуляцію використовують при очищенні води, яка поступає у водопровідну мережу.
До води додають Fe2 (S04 )3 або Al2 (S04 )3, які є добрими коагулянтами. Крім цього, ці солі гідролізують з утворенням золів гідроксидів. Частинки цих золів мають заряд, протилежний до знаку заряду колоїдних частинок, присутніх у воді. Відбувається взаємна коагуляція.
Коагулююча дія електролітів характеризується порогом коагуляції, тобто найменшою концентрацією електроліту, що викликає коагуляцію золю. Коагуляцію спричиняє іон електроліту, який має заряд, протилежний до заряду гранули (колоїдної частинки). Чим вищий заряд коагулюючого іону, тим сильніше виражена його коагулююча здатність і тим нижчий поріг коагуляції. Згідно з правилом Шульце-Гарді, значення порогів коагуляції (у) для одно-, дво- і тризарядних іонів мають таке відношення:
γ1:γ2:γ3=1:(1/2)6 :(1/3)6 =1:0,016:0,0014 .
Поріг коагуляції виражається в мілімолях електроліту, що міститься в 1 л системи.
Величина, зворотна до порогу коагуляції, називається коагулюючою здатністю р:
![]()
Для негативно зарядженого золю As2S3:
![]()
Крім електростатичного фактора стабілізації, роль у стійкості дисперсних систем відіграє молекулярно-адсорбційна стабілізація. Адсорбційні шари з молекул дисперсійного середовища, поверхнево активних і високомолекулярних сполук, запобігають зближенню частинок на відстані, де діють інтенсивні сили притягання. В якості таких стабілізаторів використовують водорозчинні високомолекулярні сполуки: желатин, полівініловий спирт, поліметакрилову кислоту та інші.
