
МЕТОДИКА РЕШЕНИЯ ТИПОВЫХ ЗАДАЧ
В данном методическом пособии задачи решаются с использованием физической величины ''количество вещества'' и единицы ее измерения ''моль''. При составлении текста задач пользовались общепринятыми положениями, которые выражаются в следующем:
а) указывать какую физическую величину следует определить в задаче, к примеру: ''определите массу вещества, объем газа, количество вещества, объем раствора, массу раствора, количество теплоты и т. д. (вместо часто встречающегося выражения: ''сколько хлорида натрия получится, если…). Ученик, решая задачу, должен четко представлять, какую физическую величину ему следует найти в задаче.
б) в тексте задачи указывать, какие вещества, растворы, смеси и т. д. даются для решения задачи, затем указать физическую величину вещества, далее число, выражающее физическую величину и единицу измерения физической величины, к примеру: ''При взаимодействии хлора объемом 20 л…''; или: ''… получилась медь количеством вещества 2,5 моль''; или: ''… выпал осадок хлорида серебра массой 10 г.'' и т. д. (вместо встречающихся выражений типа: ''при взаимодействии 20 л хлора…''; или: ''… получили 2 моль меди''; или: ''… образовалось 10 г осадка сульфата бария'') и т. д.
Методика решения задач имеет свои характерные особенности:
а![]() )
межпредметная основа при систематическом
использовании математических формул,
рассматриваемых в химии зависимостей
типа:
)
межпредметная основа при систематическом
использовании математических формул,
рассматриваемых в химии зависимостей
типа:
![]() ;
;
![]() ;
Cm
= v/
Vр-ра
(л)
;
Cm
= v/
Vр-ра
(л)
(вместо распространенного приема решения задач с использованием пропорциональной зависимости).
б) дедуктивная логика раскрытия схемы решения расчетной задачи. Она выражается приведением математического выражения, по которому рассчитывают итоговый ответ на поставленный вопрос задачи, далее анализ этой математической зависимости для нахождения нужной, но неизвестной величины, затем расчет этой величины и т. д.
в) в ходе химических расчетов обязательно указание всех единиц измерения физических величин, используемых в решении задач.
При оформлении ''дано'' задачи следует правильно записывать данные:
m (NaCl) – масса индивидуального вещества – хлорида натрия,
m (HCl) – масса хлороводорода (а не соляной кислоты),
m р-ра (HCl) – масса соляной кислоты (масса раствора хлороводорода),
m р-ра (K2SO4) – масса раствора сульфата калия,
ν (H2SO4) – количество вещества безводного вещества H2SO4,
ν (N2) - количество вещества азота,
Vm - молярный объем газа,
V (NH3) - объем аммиака,
V р-ра (CaCl2) – объем раствора хлорида кальция,
ρ (O2) - плотность индивидуального вещества – газообразного кислорода
ρ р-ра (KCl) – плотность раствора хлорида калия,
M (HCl) – молярная масса хлороводорода,
Mr (HNO3) – относительная молекулярная масса безводного вещества состава HNO3,
ω (NaCl) – массовая доля раствора хлорида натрия,
ω% (HNO3) – массовая доля раствора азотной кислоты в (%),
ω% (C) - массовая доля (%) элемента углерода в каком-либо соединении (СО2, СН4, Na2CO3 и т. д.),
ω% (FeS2) – массовая доля дисульфида железа в природном минерале пирите (в смеси),
φ% (O2) – объемная доля кислорода в газовой смеси,
η% (Na2CO3) – массовая доля в (%) выхода карбоната натрия от теоретически возможного,
Cm (H2SO4) – молярная концентрация раствора серной кислоты (моль/ л),
S (KCl)– растворимость хлорида калия (г/л) при постоянной температуре
DH 2(CH4) – относительная плотность метана по водороду,
Q – количество теплоты,
υ х.р. – скорость химической реакции,
NA - число Авагадро,
N (C) – число частиц в веществе (число атомов углерода в определенной порции вещества: углерода, алмаза и др.).
При решении задач следует помнить:
1.Если масса реагирующего вещества выражена в граммах, то объем получаемого газа выражается в литрах (дм3). Если же масса дана в килограммах, то объем получаемого газа выражается в кубических метрах (м3).
2.При
использовании в расчетах массы, выраженной
в кг, молярную массу следуют выражать
в кг/кмоль, количество вещества в кмоль,
а молярный объем газа в м3/кмоль,
например:
![]()
Рассмотрим следующую ситуацию: ''требуется определить объем раствора массой 20 кг и плотностью 1,05 г/см3 ''. В этом случае значение плотности необходимо умножить и разделить на 1000, т.е.
![]()
![]() =
=
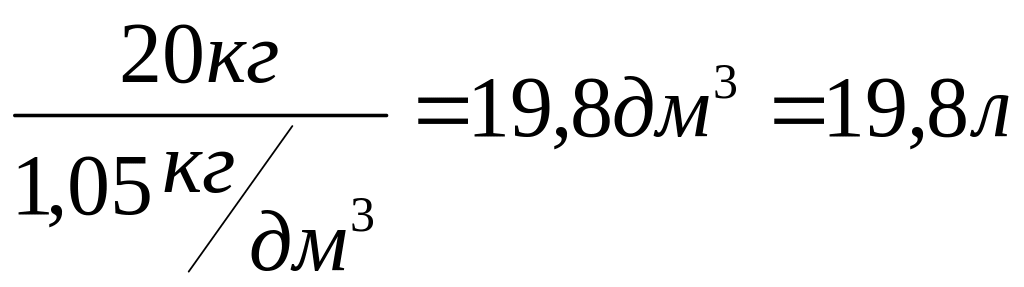
VIII класс
1. Вычисление относительной молекулярной массы
Пример 1. Вычислите двумя способами относительную молекулярную массу карбоната калия, содержащегося в древесной золе. Какое применение находит это вещество в хозяйственной деятельности сельского жителя?
Дано: а) Аr (К)=39 б) 1/12 m (С)=1,66·10-24 г
Аr (С)=12 m (K2CO3)=229·10-24г
Аr (О)=16
Найти: Мr (K2 CO3 ) - ?
Решение: а) Mr (K2 CO3) = 2Ar (K) + Ar (C) + 3Ar (O)
![]()
б) Mr (K2 CO3) = m (K2 CO3) : 1/12m ( C )
![]()
Ответ: Относительная молекулярная масса К2СО3 равна 138.
Пример 2. Относительная молекулярная масса углекислого газа, используемого для внекорневой подкормки растений в теплицах равна 44, а масса молекулы СО2 равна 73,2 ·10-24 г. Вычислить: а) относительную атомную массу углерода, б) массу атома углерода. Масса атома кислорода равна 26,6·10-24 г.
Дано: Мr (СО2) = 44
m (СО2) = 73,2 ·10-24 г
mа (О) = 26,6 ·10-24 г
Найти: Аr (С)-?
ma (C ) -?
Решение:
а)
![]() ,
,
![]()
![]() ,
,
![]()
б)
![]() ,
,
![]()
![]()
Ответ: Относительная атомная масса углерода равна 12. Масса атома углерода равна 20·10-24 г.
Пример 3. Вычислите относительные молекулярные массы веществ, используемых в фермерских хозяйствах: а) хлорид кальция СаСl2 – для подкормки животных; б) оксид серы (IV) SO2 – для уничтожения паутинового клещика в теплицах; в) безводный раствор аммиака NH3 – для обогащения азотом почвы. Какие простые вещества образуют элементы, входящие в состав этих сложных веществ?
Дано: а) Аr (Са) = 40 б) Аr(S) =32 в) Аr(N) =14
Аr(Cl) =35,5 Аr (О) =16 Аr (Н) =1
Найти: а) Мr (СаСl2) - ? б) Мr (SO2) - ? в) Mr (NH3) - ?
Решение: Простые вещества:
а)![]() Са,
Сl2,
N2,
H2,
(S8),О2.
Са,
Сl2,
N2,
H2,
(S8),О2.
![]()
б)![]() .
.
![]()
в)![]()
![]()
Ответ: а) относительная молекулярная масса СаСl2 равна 111; б) относительная молекулярная масса SО2 равна 64; в) относительная молекулярная масса NН3 равна 17; элементы образуют простые вещества: Ca, Cl2, S (S8), O2, N2, H2.
Пример 4. Вычислите относительные молекулярные массы ниже перечисленных веществ, применяемых для известкования почв: CaCO3, MgCO3 и К2СО3. Запишите отношения относительных атомных масс элементов, входящих в состав данных веществ.
Пример 5. Для подкормки комнатных растений используют раствор калиевой селитры КNО3. Определите относительную молекулярную массу селитры. Запишите, какие химические элементы входят в ее состав и какие простые вещества они образуют?
Пример 6. В состав горючего сельскохозяйственных машин входит вещество гексан, содержащее 6 атомов углерода и 14 атомов водорода. 1) Напишите химическую формулу гексана; 2) Вычислите его относительную молекулярную массу.
2. Вычисление массовой доли (%) элементов по формулам веществ.
Пример 1. В целях повышения урожайности томатов в земледелии применяют раствор аммиака NН3. Вычислите массовую долю питательного элемента азота в этом соединении.
Дано: Mr (NH3) = 17
Ar (N) =14
Найти: ω% (N) - ?
Решение: 1.Напишем математическую формулу расчета:
![]()
2.
Подставим данные в формулу:
![]()
Ответ: Массовая доля азота в аммиаке равна 82,4%.
Пример 2. Для почвы, бедной азотом, можно внести нитрат калия КNО3 и нитрат натрия NаNО3. Какое удобрение вы бы использовали для обогащения азотом почвы? Почему?
Дано: КNО3, NаNO3
Найти: ω% (N) - ?
