
- •Работа №1 Измерение импульсного магнитного поля
- •Работа №2 Измерение магнитных и диэлектрических свойств рудного материала
- •Устройство и принцип работы прибора
- •Порядок работы
- •Обработка данных
- •Определение положения магнитного тела в грунте
- •Работа № 4 Кинетика процесса электролиза воды
- •Работа № 5 Электропотенциал углей
- •Работа № 6
- •Работа №7 Протонный магнитометр
- •Работа № 8 Эффект Степанова
- •Работа № 10 Эффект Томсона
- •Работа № 11 Магнитокинетический эффект
Работа № 4 Кинетика процесса электролиза воды
Цель работы - отработка различных режимов работы электролизера и определение зависимости кинетики данного процесса, которая обеспечивает возможность управлять им.
Общие сведения
Понятие процесса электролиза заключается в том, что при ионной проводимости прохождение тока связанно с переносом вещества. На электродах происходит выделение веществ, входящих в состав электролитов. На аноде отрицательно заряженные ионы отдают свои лишние электроны, а на катоде положительные ионы получают недостающие электроны. Электролизом называют процесс электрохимического разделения воды в условиях электролитической диссоциации, связанный с окислительно- восстановительной реакцией.
Электрическое поле в электролите создается между токопроводящими пластинками, которые погружаются в электролит (водный раствор); эти пластинки называются электродами. Электроды соединяются с полюсами источника ЭДС; электрод, соединенный с положительным полюсом, называется анодом; электрод, соединенный с отрицательным полисом, называется катодом.
Положительные ионы, перемещающиеся в электрическом поле к катоду, называются катионами; отрицательные ионы, перемещающиеся к аноду, называются анионами.
Процессы на электродах могут быть выражены в виде следующих уравнений:
На катоде 2Н2О + 2е − Н2+ 2ОН−
На аноде Н2О − 2е − 2Н+ +1/2О2
В промышленности для получения водорода и кислорода электролизу подвергаются водные растворы щелочей - NaOH или КОН. Большое количество металлов извлекаются из руд и подвергаются переработке с помощью электролиза (электроэкстракция, электрорафинирование).
Фарадей установил, что масса M вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду Q, прошедшему через электролит:
M = k . Q = k . I . Δt,
если через электролит пропускается в течение времени Δt постоянный ток с силой тока I. Коэффициент пропорциональности называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Химическим эквивалентом иона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент
![]()
где F — постоянная Фарадея.
Первый закон Фарадея записывается в следующем виде:
![]()
где
![]() —
молярная масса данного вещества,
образовавшегося (однако не обязательно
выделившегося — оно могло и вступить
в какую-либо реакцию сразу после
образования) в результате электролиза),
—
молярная масса данного вещества,
образовавшегося (однако не обязательно
выделившегося — оно могло и вступить
в какую-либо реакцию сразу после
образования) в результате электролиза),
![]() -
сила тока, пропущенного через вещество
или смесь веществ (раствор, расплав),
-
сила тока, пропущенного через вещество
или смесь веществ (раствор, расплав),
![]() -
время, в течение которого проводился
электролиз,
-
время, в течение которого проводился
электролиз,
![]() -
постоянная Фарадея (96 485,3383(83) Кл·моль−1),
-
постоянная Фарадея (96 485,3383(83) Кл·моль−1),
![]() -
число участвующих в процессе электронов.
-
число участвующих в процессе электронов.
Целью данной работы являлось выявление возможности управлять процессом электролиза водного раствора. Для этого устанавливались зависимости параметров реакции: объем газа от времени V(t), скорости от напряжения v(U), плотности тока от напряжения j(U) и плотности тока от скорости j(v). Все зависимости установлены с помощью измерений объемов выделяющегося газа
Методика выполнения работы:
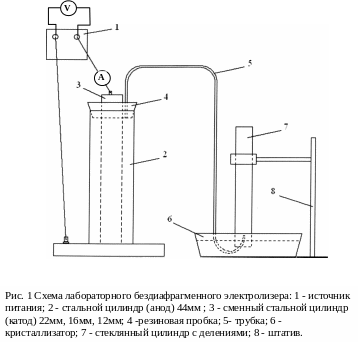
Собрать установку, как показано на рис. 1.
Провести первый опыт, используя внутренний цилиндр с d = 22 мм:
- включить питание, настроить нужное напряжение (30B, 20В, 10В);
- зафиксировать значение силы тока при объеме выделившегося газа равного нулю;
- измерить объем газа (водорода) с интервалом 1 мин. в течение четырех минут.
3. Повторить опыт, меняя d внутренних цилиндров (d = 16 мм, 12мм).
Данные измерения внести в таблицу, произвести вычисления сопротивления, удельного сопротивления, плотности тока, скорости выделения газа.
Построить графики V(t), v(U), j(U), j(V), определить зависимость.
По экспериментальным данным рассчитать постоянную Фарадея и сравнить с табличным значением.
d вн. цилиндра, мм |
Напряжение U, В |
Время t, мин |
Сила тока I, A |
Объем газа V, мл |
Сопротивление R, Ом |
Удельное сопротивление ρ, Ом.м |
Плотность тока j, А/м2 |
Скорость v, мл/мин |
|
|
|
|
|
|
|
|
|
Контрольные вопросы
Как электропроводность раствора зависит от концентрации ионов соли в воде?
На каком электроде выделяется водород, а на каком – кислород?
Какой из электродов в наибольшей степени подвержен коррозии?
