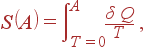- •Равновесные состояния и равновесные процессы
- •1. Термодинамические параметры p,V,t. Уравнение состояния
- •Первый закон (начало) термодинамики
- •Теплоемкость – есть функция процесса Различают теплоемкость при постоянном V , следовательно и теплоемкость при постоянном p
- •Энтропия в термодинамике
- •Основные свойства энтропии:
- •Закон возрастания энтропии
- •6) Вычисление энтропии равновесных систем
- •Третий закон термодинамики (теорема Нернста)
- •"Тепловая смерть" вселенной
- •Тепловая смерть Вселенной
6) Вычисление энтропии равновесных систем
Для
переменных T
и V
изменение
энтропии
![]()
Для
идеального газа U
= cV
dT
получим в
расчёте на один моль
![]() .
.
Интегрируя,
получим,
![]() где s0
- константа интегрирования.
где s0
- константа интегрирования.
Третий закон термодинамики (теорема Нернста)
Определение энтропии не является однозначным, поскольку в энтропию входит неопределенная константа s0. Значение этой аддитивной константы, возникающей при определении энтропии, устанавливается теоремой Нернста, которую часто называют третьим законом термодинамики: энтропия любой системы при абсолютном нуле температуры всегда может быть принята равной нулю.
Физический смысл теоремы состоит в том, что при T = 0 все возможные состояния системы имеют одинаковую энтропию. Тогда энтропию произвольного состояния A можно определить интегралом
|
|
где интегрирование производится вдоль обратимого процесса, начинающегося от состояния при T = 0 и заканчивающегося состоянием A.
В термодинамике теорема Нернста принимается как постулат. Доказывается она методами квантовой статистики.
При T→ 0 теплоемкость так же должна стремиться к нулю:
C(0) → 0 . |
|
Этот вывод находится в согласии с экспериментальными данными.
Основное термодинамическое тождество (неравенство)
![]()
В этом выражении знак равенства соответствует равновесным термодинамическим процессам, а знак неравенства - неравновесным. Оно объединяет I и II законы т/д-ки – закон сохранения энергии и закон возрастания энтропии.
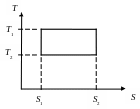
T-s диаграммы
Для анализа круговых процессов удобно взять в качестве независимых переменных температуру и энтропию – T-s диаграмма.
Используя
определение теплоемкости, запишем
уравнение
![]() интегрируя это уравнение, получим
выражение всех политропических процессов
в T-s
диаграмме:
интегрируя это уравнение, получим
выражение всех политропических процессов
в T-s
диаграмме:
![]()
![]()
Построить изобару, изохору, адиабату, изотерму в T-s диаграмме.
Цикл Карно – две изотермы и две адиабаты (изоэнтропы) :
![]() ;
;![]() ;
;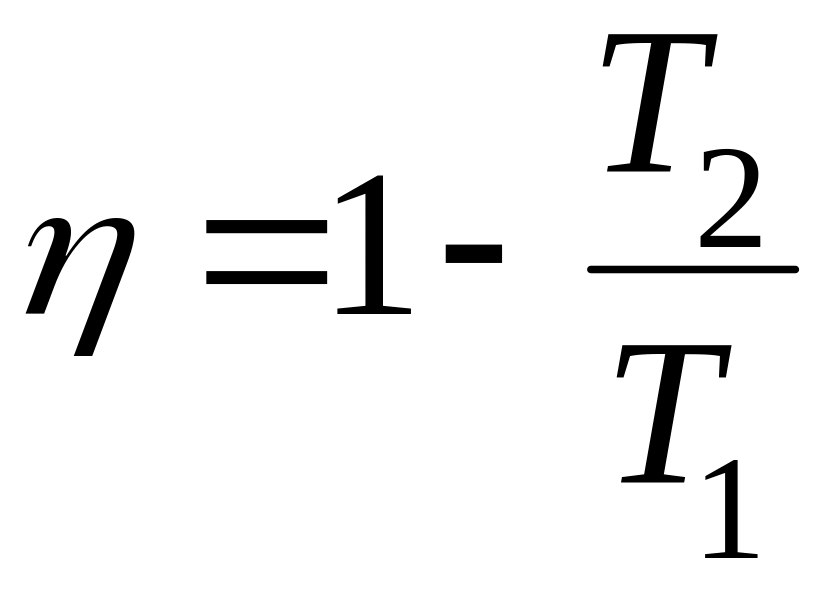 что
и следовало ожидать. КПД любого другого
цикла (не Карно) меньше Карно
при тех же
Т1 и Т2.
Доказать самостоятельно.
что
и следовало ожидать. КПД любого другого
цикла (не Карно) меньше Карно
при тех же
Т1 и Т2.
Доказать самостоятельно.
Химический потенциал
Пусть
т/дин-я система обменивается с окружающей
средой не только теплом, но и частицами.
Запишем I-е
начало в расчёте на одну частицу:
![]() ,
где обозначено:
,
где обозначено:
![]() ,
,
![]() ,
,
![]() – энтропия, энергия
и объём приходящиеся на одну частицу.
– энтропия, энергия
и объём приходящиеся на одну частицу.
Подставим:
![]() и продифференцируем,
получим
и продифференцируем,
получим
![]()
Перегруппируем
![]() .
.
Обозначим
и назовём
![]() – химический
потенциал – энергия,
добавления одной частицы в систему без
совершения работы.
– химический
потенциал – энергия,
добавления одной частицы в систему без
совершения работы.
Химический потенциал
входит в первое начало термодинамики
и представляет собой энергию добавления
одной частицы в систему без совершения
внешней работы. В частном случае при
постоянных температуре и давлении, и
при неизменном составе вещества
химический потенциал может быть найден
через потенциал Гиббса:
![]() ,
тогда
,
тогда
![]() .
.
Теплоёмкость газов
В классической теории молярная теплоёмкость зависит только от числа степеней свободы и не зависит от температуры (почему она не зависит от массы молекул?):
изохорная
![]() ;
изобарная
;
изобарная
![]() .
.
Д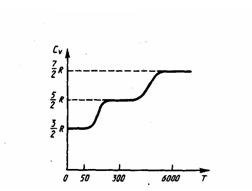 ля
двухатомных газов должно быть
ля
двухатомных газов должно быть
![]() ,
однако эксперимент показывает, что
т/ёмкость зависит от Т и при низких
Т (<1К) стремится к нулю.
,
однако эксперимент показывает, что
т/ёмкость зависит от Т и при низких
Т (<1К) стремится к нулю.
Экспериментальная зависимость молярной теплоемкости СV водорода:
при низкой температуре (≈50 К) СV = (3/2)R,
п
10 50 300
6000 Т
и при очень высокой — СV= (7/2)R.
К вантование
энергии молекул позволяет объяснить
это: при низких температурах наблюдается
только поступательное движение
молекул, при средних ~300K
– вращательное, а при высоких –
колебательное движение молекул.
вантование
энергии молекул позволяет объяснить
это: при низких температурах наблюдается
только поступательное движение
молекул, при средних ~300K
– вращательное, а при высоких –
колебательное движение молекул.
При нахождении теплоемкости надо учитывать квантование энергии вращения и колебаний молекул (возможны не любые вращательные и колебательные энергии, а лишь фиксированный дискретный ряд значений энергий). Если энергия теплового движения недостаточна, например, для начала колебаний, то эти колебания не вносят своего вклада в теплоемкость (соответствующая степень свободы не участвует в процессе — к ней неприменим закон равнораспределения энергии). Этим объясняется, что теплоемкость моля двухатомных газов при комнатной температуре равна (5/2)R вместо (7/2)R. Аналогичным образом можно объяснить уменьшение теплоемкости при низкой температуре (не участвуют вращательные степени свободы) и увеличение при высокой (начинают участвовать в процессе колебательные степени свободы).
Второе начало термодинамики, принцип, устанавливающий необратимость макроскопических процессов, протекающих с конечной скоростью. В отличие от чисто механических (без трения) или электродинамических (без выделения джоу-левой теплоты) обратимых процессов, процессы, связанные с теплообменом при конечной разности температур (т. е. текущие с конечной скоростью), с трением, диффузией газов, расширением газов в пустоту, выделением джоулевой теплоты и т.д., необратимы, т. е. могут самопроизвольно протекать только в одном направлении (см. Необратимые процессы). Исторически Второе начало термодинамики возникло из анализа работы тепловых машин (С. Карно, 1824). Существует несколько эквивалентных формулировок Второе начало термодинамики Само название «Второе начало термодинамики» и исторически первая его формулировка (1850) принадлежат Р. Клаузиусу: невозможен процесс, при котором теплота переходила бы самопроизвольно от тел более холодных к телам более нагретым. При этом самопроизвольный переход не следует понимать в узком смысле: невозможен не только непосредственный переход, его невозможно осуществить и с помощью машин или приборов без того, чтобы в природе не произошло ещё каких-либо изменений. Иными словами, невозможно провести процесс, единственным следствием которого был бы переход теплоты от более холодного тела к более нагретому. Если бы (в нарушение положения Клаузиуса) такой процесс оказался возможным, то можно было бы, разделив один тепловой резервуар на 2 части и переводя теплоту из одной в другую, получить 2 резервуара с различными температурами. Это позволило бы, в свою очередь, осуществить Карно цикл и получить механическую работу с помощью периодически действующей (т. е. многократно возвращающейся к исходному состоянию) машины за счёт внутренней энергии одного теплового резервуара. Поскольку это невозможно, в природе невозможны процессы, единственным следствием которых был бы подъём груза (т. е. механическая работа), произведённый за счёт охлаждения теплового резервуара (такова формулировка Второе начало термодинамики, данная У. Томсоном, 1851). Обратно, если бы можно было получить механическую работу за счёт внутренней энергии одного теплового резервуара (в противоречии с Второе начало термодинамики по Томсону), то можно было бы нарушить и положение Клаузиуса. Механическую работу, полученную за счёт теплоты от более холодного резервуара, можно было бы использовать для нагревания более тёплого резервуара (например, трением) и тем самым осуществить переход теплоты от холодного тела к нагретому. Обе приведённые формулировки Второе начало термодинамики, являясь эквивалентными, подчёркивают существенное различие в возможности реализации энергии, полученной за счёт внешних источников работы, и энергии беспорядочного (теплового) движения частиц тела. Возможность использования энергии теплового движения частиц тела (теплового резервуара) для получения механической работы (без изменения состояния других тел) означала бы возможность реализации так называемого вечного двигателя 2-го рода, работа которого не противоречила бы закону сохранения энергии. Так, работа двигателя корабля за счёт охлаждения забортной воды океана - доступного и практически неисчерпаемого резервуара внутренней энергии - не противоречит закону сохранения энергии, но если, кроме охлаждения воды, нигде других изменений нет, то работа такого двигателя противоречит Второе начало термодинамики В реальном тепловом двигателе процесс превращения теплоты в работу обязательно сопряжён с передачей определённого количества теплоты внешней среде. В результате тепловой резервуар двигателя охлаждается, а более холодная внешняя среда нагревается, что находится в согласии со Второе начало термодинамики Следовательно, Второе начало термодинамики можно формулировать и как невозможность вечного двигателя 2-го рода.
В современной термодинамике Второе начало термодинамики формулируется единым и самым общим образом как закон возрастания особой функции состояния системы, которую Клаузиус назвал энтропией (обозначается S). Согласно этому закону, в замкнутой системе энтропия S при любом реальном процессе либо возрастает, либо остаётся неизменной, т. е. изменение энтропии dS ³ 0; знак равенства имеет место для обратимых процессов. В состоянии равновесия энтропия замкнутой системы достигает максимума и никакие макроскопические процессы в такой системе, согласно Второе начало термодинамики, невозможны. Для незамкнутой системы направление возможных процессов, а также условия равновесия могут быть получены из закона возрастания энтропии, примененного к составной замкнутой системе, получаемой путём присоединения всех тел, участвующих в процессе.
Второе начало термодинамики, несмотря на свою общность, не имеет абсолютного характера, и отклонения от него (флуктуации) являются вполне закономерными. Примерами таких флуктуационных процессов являются броуновское движение тяжёлых частиц, равновесное тепловое излучение нагретых тел (в том числе радиошумы), возникновение зародышей новой фазы при фазовых переходах, самопроизвольные флуктуации температуры и давления в равновесной системе и т.д.
Статистическая физика, построенная на анализе микроскопического механизма явлений, происходящих в макроскопических телах, и выяснившая физическую сущность энтропии, позволила понять природу Второе начало термодинамики, определить пределы его применимости и устранить кажущееся противоречие между механической обратимостью любого, сколь угодно сложного микроскопического процесса и термодинамической необратимостью процессов в макротелах.
Как показывает
статистическая термодинамика (Л.
Больцман,
Дж. Гиббс),
энтропия системы связана со статистическим
весом Р
макроскопического состояния:
S
= klnP
(k -
Больцмана
постоянная).
Статистический вес Р
пропорционален числу различных
микроскопических реализаций данного
состояния макроскопической системы
(например, различных распределений
значений координат и импульсов молекул
газа, отвечающих определённому значению
энергии, давления и других термодинамических
параметров газа), т. е. характеризует
как бы степень неточности микроскопического
описания макросостояния. Для замкнутой
системы вероятность
термодинамическая
W
данного макросостояния пропорциональна
его статистическому весу и определяется
энтропией системы:
W~exp(S/k).
(2)
Таким образом, закон
возрастания энтропии имеет
статистически-вероятностный характер
и выражает постоянную тенденцию системы
к переходу в более вероятное состояние.
Максимально вероятным является состояние
равновесия; за достаточно большой
промежуток времени любая замкнутая
система достигает этого состояния.
Энтропия является величиной аддитивной
(см. Аддитивность),
она пропорциональна числу частиц в
системе. Поэтому для систем с большим
числом частиц даже самое ничтожное
относительное изменение энтропии,
приходящейся на одну частицу, существенно
меняет её абсолютную величину; изменение
же энтропии, стоящей в показателе
экспоненты в ур-нии (2), приводит к
изменению вероятности данного
макросостояния W
в огромное число раз. Именно этот факт
является причиной того, что для системы
с большим числом частиц следствия Второе
начало термодинамики
практически имеют не вероятностный, а
достоверный характер. Крайне маловероятные
процессы, сопровождающиеся сколько-нибудь
заметным уменьшением энтропии, требуют
столь огромных времён ожидания, что их
реализация является практически
невозможной. В то же время малые части
системы, содержащие небольшое число
частиц, испытывают непрерывные флуктуации,
сопровождающиеся лишь небольшим
абсолютным изменением энтропии. Средние
значения частоты и размеров этих
флуктуаций являются таким же достоверным
следствием статистической термодинамики,
как и само Второе
начало термодинамики
Проиллюстрируем сказанное примером,
позволяющим оценить масштабы величин,
определяющих точность Второе
начало термодинамики
и отклонения от него. Рассмотрим
флуктуационный процесс, в результате
которого N
частиц, первоначально занимающих объём
V,
равный 1 мкм3
(т. е. 10-18
м3),
сконцентрируется самопроизвольно в
половине этого объёма. Отношение
статистических весов начального (1) и
конечного (2) состояний:
![]() поэтому
изменение энтропии DS/k
= Nin2
и отношение вероятностей W1/W2
= 2N.
Если время пролёта частицы через объём
V,
т. е. время, в течение которого сохраняется
данная флуктуация, t = 10-8
сек,
то среднее время ожидания такой флуктуации
t
=2N·t
» 100,3N·t.
При числе частиц N
= 30, t
= 10
сек,
при N
= 100, t
» 1022
сек »
1015
лет. Если же учесть, что при атмосферное
давлении число частиц газа в 1 мкм3
составляет N
~ 108,
то время ожидания указанного события
поэтому
изменение энтропии DS/k
= Nin2
и отношение вероятностей W1/W2
= 2N.
Если время пролёта частицы через объём
V,
т. е. время, в течение которого сохраняется
данная флуктуация, t = 10-8
сек,
то среднее время ожидания такой флуктуации
t
=2N·t
» 100,3N·t.
При числе частиц N
= 30, t
= 10
сек,
при N
= 100, t
» 1022
сек »
1015
лет. Если же учесть, что при атмосферное
давлении число частиц газа в 1 мкм3
составляет N
~ 108,
то время ожидания указанного события
![]() Буквальное применение Второе
начало термодинамики
к Вселенной как целому, приведшее
Клаузиуса к неправильному выводу о
неизбежности «тепловой смерти Вселенной»,
является неправомерным, так как любая
сколь угодно большая часть Вселенной
не является сама по себе замкнутой и её
приближение к состоянию теплового
равновесия, даже не говоря о флуктуациях,
не является абсолютным.
Термодинамическое же описание Вселенной
как целого возможно лишь в рамках общей
теории относительности, в которой вывод
о приближении энтропии к максимуму не
имеет места.
Буквальное применение Второе
начало термодинамики
к Вселенной как целому, приведшее
Клаузиуса к неправильному выводу о
неизбежности «тепловой смерти Вселенной»,
является неправомерным, так как любая
сколь угодно большая часть Вселенной
не является сама по себе замкнутой и её
приближение к состоянию теплового
равновесия, даже не говоря о флуктуациях,
не является абсолютным.
Термодинамическое же описание Вселенной
как целого возможно лишь в рамках общей
теории относительности, в которой вывод
о приближении энтропии к максимуму не
имеет места.