
- •Равновесные состояния и равновесные процессы
- •1. Термодинамические параметры p,V,t. Уравнение состояния
- •Первый закон (начало) термодинамики
- •Теплоемкость – есть функция процесса Различают теплоемкость при постоянном V , следовательно и теплоемкость при постоянном p
- •Энтропия в термодинамике
- •Основные свойства энтропии:
- •Закон возрастания энтропии
- •6) Вычисление энтропии равновесных систем
- •Третий закон термодинамики (теорема Нернста)
- •"Тепловая смерть" вселенной
- •Тепловая смерть Вселенной
Энтропия в термодинамике
Для цикла Карно справедливо равенство
(учтём, что
![]() )
)
![]() или
или
![]()
Любой обратимый цикл можно представить
как бесконечное число бесконечно узких
циклов Карно и записать для него
уравнение Клаузиуса
![]() .
Интеграл Клаузиуса
.
Интеграл Клаузиуса
![]() .
.
Существует функция состояния –
энтропия,
дифференциал которой равен
приведённой теплоте
![]() .
.
Основные свойства энтропии:
Для кругового обратимого цикла
 и S
= 0.
и S
= 0.Для обратимого процесса изменение энтропии не зависит от процесса, а определяется начальным и конечным состояниями (как и для внутренней энергии U)
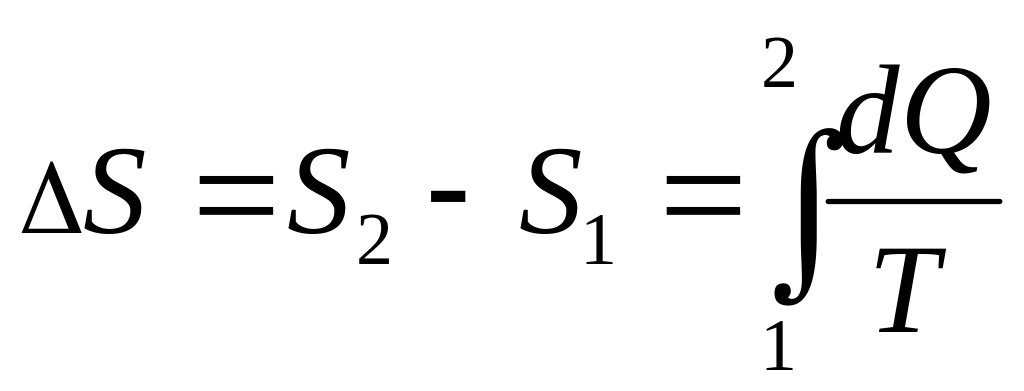 .
.Если же цикл включает в себя необратимый процесс и оказывается необратимым, то уравнение не выполняется и имеет место неравенство Клаузиуса
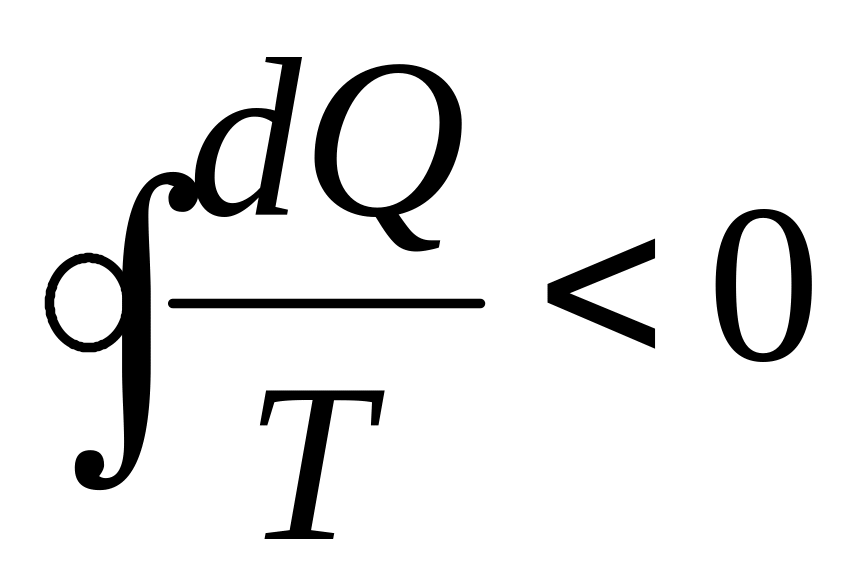 ,
что легко доказать из
,
что легко доказать из

Р
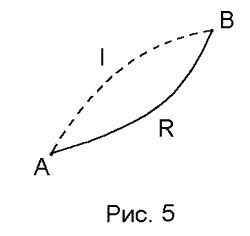 ассмотрим
цикл, в котором один процесс необратимый
(АIB),
а второй обратимый
(ARB).
ассмотрим
цикл, в котором один процесс необратимый
(АIB),
а второй обратимый
(ARB).
Изменение
энтропии при переходе из состояния A
в B
по обратимому процессу
![]() .
.
Чтобы определить изменение энтропии для необратимого процесса, рассмотрим необратимый цикл AIBRA, состоящий из необратимого процесса I от A до B и обратимого процесса R от B до A.
Применяя
неравенство Клаузиуса к этому циклу,
имеем:
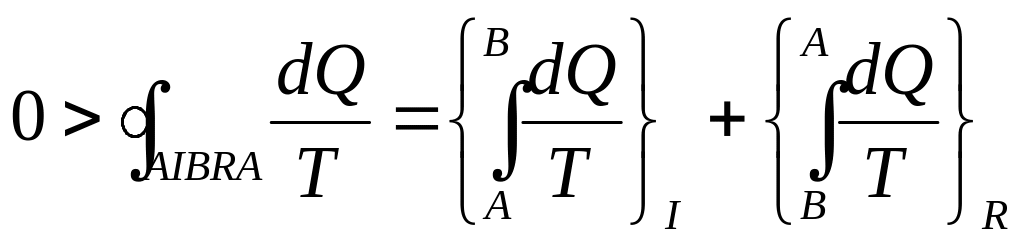
Для
обратимого процесса (BRA):![]() .
Используем это и получим неравенство
.
Используем это и получим неравенство

где интеграл берется по произвольному необратимому процессу I от A до B. Т.е. изменение энтропии в необратимом процессе больше приведённой теплоты – имеет место производство энтропии за счёт неравновесности процесса!
Закон возрастания энтропии
Применим
последнее неравенство к изолированной
системе,
которая никак не взаимодействует с
окружающей средой. Поскольку для такой
системы δ Q = 0,
то получаем
![]()
Для любого процесса в изолированной системе энтропия конечного состояния не может быть меньше энтропии начального состояния. Это – закон возрастания энтропии.
Если
процесс обратим, то при достижении
максимального значения в состоянии
равновесия энтропия системы не меняется
![]() .
.
Закон возрастания энтропии справедлив только для изолированных систем. С помощью внешней системы можно уменьшить энтропию тела. Однако суммарная энтропия тела и внешней системы уменьшиться не может.
Если изолированная система находится в состоянии с максимальной энтропией, соответствующей её энергии, то в ней не могут происходить никакие процессы, поскольку любой процесс привел бы к уменьшению энтропии.
Таким образом, состояние с максимальной энтропией является наиболее устойчивым состоянием изолированной системы.
Самопроизвольные процессы в изолированных системах идут в направлении роста энтропии. Примеры.
1. Рассмотрим теплообмен между двумя частями системы A1 и A2, имеющими температуры T1 и T2. Пусть T1<T2. Теплота передается от горячего тела к холодному. Поэтому тело A2 передаст телу A1 некоторое количество теплоты Q, т.е.
Δ Q1 = Q , Δ Q2 = –Q . |
При этом энтропия тела A1 изменится на величину Δ Q1/T1 , а энтропия тела A2 – на величину Δ Q2/T2 . Общее изменение энтропии системы
|
(46) |
Поскольку T1<T2 , то Δ S>0 .
2. Рассмотрим теперь выделение теплоты при трении. Энтропия тела, которое нагревается при трении, возрастает. Это увеличение энтропии не компенсируется уменьшением энтропии других частей системы, так как теплота получена из работы.
