
- •Равновесные состояния и равновесные процессы
- •1. Термодинамические параметры p,V,t. Уравнение состояния
- •Первый закон (начало) термодинамики
- •Теплоемкость – есть функция процесса Различают теплоемкость при постоянном V , следовательно и теплоемкость при постоянном p
- •Энтропия в термодинамике
- •Основные свойства энтропии:
- •Закон возрастания энтропии
- •6) Вычисление энтропии равновесных систем
- •Третий закон термодинамики (теорема Нернста)
- •"Тепловая смерть" вселенной
- •Тепловая смерть Вселенной
ОБЩИЕ ЗАКОНЫ ТЕРМОДИНАМИКИ
Равновесные состояния и равновесные процессы
Работа
Температура
Идеальные газы
Первый закон термодинамики
Теплоемкость
Применение 1-го закона термодинамики к газам
Адиабатические и политропические процессы в газах
Второй закон термодинамики
Цикл Карно. Коэффициент полезного действия обратимой тепловой машины
Энтропия
Закон возрастания энтропии
Энтропия равновесных систем
Третий закон термодинамики (теорема Нернста)
Равновесные состояния и равновесные процессы
Термодинамические параметры P,V,T,(и количество вещества ν – число молей).
Равновесные и неравновесные состояния (не путать со стационарными состояниями): состояние при котором P,V,T–const.
Т/дин-е равновесие (Т/д равновесное состояние)
Равновесный (квазистатический) процесс в термодинамике, процесс перехода термодинамической системы из одного равновесного состояния в другое, столь медленный, что все промежуточные состояния можно рассматривать как равновесные, т. е. характеризующиеся очень медленным (в пределе — бесконечно медленным) изменением термодинамической параметров состояния. Р. п.— одно из основных понятий термодинамики равновесных процессов. Всякий Р. п. является обратимым процессом и, наоборот, любой обратимый процесс – равновесный.
К категории обратимых относятся процессы, для которых допускается возвращение в исходное состояние без каких либо изменений в окружающей среде. При этом прямой и обратный процессы должны проходить через одну и туже последовательность равновесных состояний. Реально в природе такие процессы не наблюдаются, но они, так же как модель идеального газа, являются удобной идеализацией, позволяющей построить описание, близкое к реальному описанию в целом ряде практически важных случаев. При этом используется модель квазистатического процесса, то есть такого процесса, который протекает с бесконечно малой скоростью. При таких процессах термодинамическая система проходит через последовательность равновесных состояний, так как все возмущения, возникающие при переходе из одного состояния в другое, успевают затухнуть из-за очень малой скорости перехода. Описанием обратимых термодинамических процессов занимается равновесная термодинамика.
1. Термодинамические параметры p,V,t. Уравнение состояния
f (T,P,V) = 0 , |
называется уравнением состояния. Вид этого уравнения зависит от конкретных свойств вещества.
Для идеального газа PV = RT ,
Написанное уравнение можно разрешить относительно одной из переменных, выразив ее через две других. Поэтому состояние системы полностью определяется какими-либо двумя переменными, например, P и V. Все термодинамические параметры и их функции являются либо функциями состояния, либо функциями процесса.

Элементарный вывод уравнения состояния идеального газа:
При
упругом ударе молекулы о стенку
![]() .
.
Давление
N
молекул
![]() .
.
Концентрация
молекул
![]() .
.
Квадрат
модуля средней скорости
![]() .
.
В
равновесном состоянии
![]()
Давление
газа
![]() .
.
Средняя
кинетическая энергия молекулы
![]() .
.
Окончательно
![]() .
.
2. Работа газа и внутренняя энергия
![]() –
функция
процесса.
–
функция
процесса.
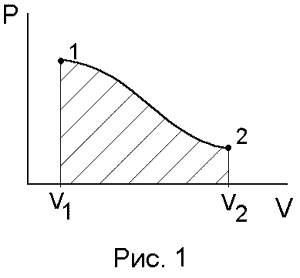
V1 и V2– начальный и конечный объемы, давление – функция объема P = f(V).
Феноменологически
внутренняя энергия определяется как
однозначная функция состояния системы,
зависящая от температуры U
= f(T)
она есть полный
дифференциал,
![]() и подлежит
экспериментальному измерению.
и подлежит
экспериментальному измерению.
МКТ даёт кинетическую трактовку, как внутренней энергии, так и температуры:
![]()
 (это
для ид. газа, т.е. в пренебрежении
потенциальной энергией взаимодействия
молекул между собой).
(это
для ид. газа, т.е. в пренебрежении
потенциальной энергией взаимодействия
молекул между собой).
Универсальная газовая постоянная
R = kNA=1,3810–23 6,021023 = 8,31 Дж/моль/K. – Работа 1-го моля газа при изобарическом процессе и изменении температуры на 1К.
Геометрическая интерпретация
работы
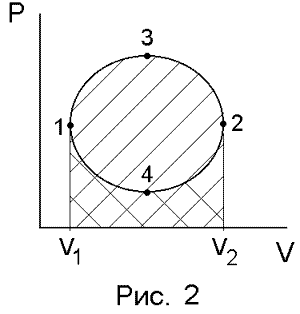
Работа кругового процесса
3. Температура – новое понятие, которое отсутствует в механике. В т/д-ке – это постулат, называется нулевым законом термодинамики.
Система, находящаяся в тепловом равновесии, имеет во всех точках одинаковую температуру. Это – необходимое условие теплового равновесия. Измерение температуры основано на уравнении состояния:
![]() ,
где Vм
– молярный объём
,
где Vм
– молярный объём
Температура является функцией состояния: она не зависит от предыстории тела и полностью определяется его состоянием в данный момент.
