
- •Глава 4. Физико-химические свойства металлических расплавов
- •1. Строение и свойства металлических расплавов
- •Дифракционный метод исследования структуры жидкости
- •1. Эффективный диаметр сферы а. 2. Коэффициент упаковки п-3. Парный потенциал межчастичного взаимодействия ф(г).
- •2. Физические свойства металлических расплавов
- •Активносги компонентов металлических расплавов, расчеты коэффициентов активности
Дифракционный метод исследования структуры жидкости
Для исследования структуры жидкости используют рентгеновское излучение, потоки нейтронов и электронов, последние пригодны для изучения тонких пленок. Рентгеновские лучи на рис. 69 от источника 1 направляются на плоскую поверхность жидкого металла. При падении на атом в жидкости они рассеиваются и интерферируют с лучами, рассеянными ближайшими соседями. Отраженные лучи попадают на пленку 3. Так как атомы в расплаве движутся, то наблюдаемый дифракционный эффект является следствием среднего распределения атомов.
На рентгеновской пленке проявляются полосы максимальной и минимальной интенсивности, эти же максимумы можно фиксировать ионизационными счетчиками.
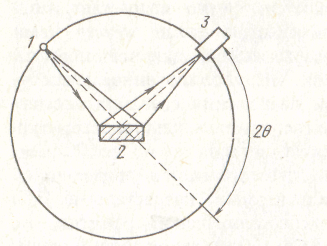
Рисунок 69 - Схема дифракционных методов исследования жидких металлов путем отражения; θ- угол рассеивания
По данным об интенсивности рассчитывают структурную постоянную жидкости а(К), равную I(К)/(Nf2), где N- число рассеивающих центров: f2 - интенсивность излучения, рассеянного одним центром, I(К) - интенсивность излучения, рассеянного на угол 2 θ, см. рис. 69. Рассчитывают так же парную функцию радиального распределения атомов от начала отсчета R(r), наиболее вероятные расстояния между атомами, координационные числа. На рис. 70 показано радиальное распределение атомов в жидком алюминии в координатах 4πr2R(r) - r, где r - расстояние от любого атома жидкости, положение которого принято за начало координат, R(r)- среднее число атомов в единице объема.
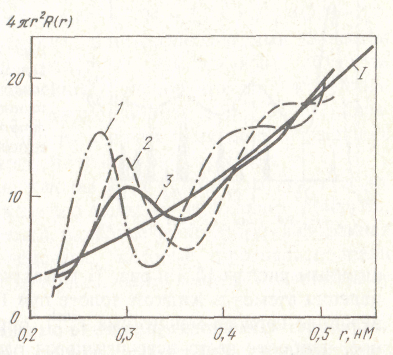
Рисунок 70 - Кривые радиального распределения атомов в жидком алюминии при t, oC: 670 (1), 720 (2), 850 (3)
По положению максимумов определяют наиболее вероятные расстояния между атомами в пределах соответствующих координационных сфер. Кривая 1 - это кривая средней плотности 4πr2R(r) - r. На рисунке четко виден первый максимум, менее четко - второй, третий уже сильно размыт. График в координатах 4πr2R(r) - r является парной функцией радиального распределения атомов R(r). Кривые парной функции радиального распределения атомов осциллируют вокруг кривой средней плотности и сливаются с ней на больших расстояниях. Это то расстояние, на которое простирается упорядоченность структуры жидкости. На более дальнем расстоянии локальная плотность распределения атомов становится равной атомной плотности жидкости. Это происходит примерно на расстояниях 1 - 1,5 нм от начала отсчета. Парная функция радиального распределения равна вероятности нахождения частицы в единице объема вещества, заключенного между сферами радиусом r и r + dr, где r - расстояние от начала отсчета, т.е. функция R(r) характеризует локальную плотность распределения атомов.
Рассмотрим изменение плотности распределения атомов в твердом кристаллическом и жидком золоте при увеличении d. Положение атома считаем по его центру. В твердом металле частицы размещены в узлах кристаллической решетки. Расстояние между ними и точкой отсчета точно фиксируется. Первая функция распределения атомов в кристаллической решетке на рис. 71 представлена вертикальными черными треугольниками. Золото имеет г.ц.к. решетку с координационным числом 12. На рис. 71 показана кривая радиального распределения атомов в жидком золоте при
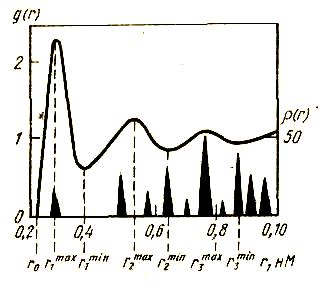
1100 oС. Видно, что положение вершины первого максимума r1max, определяющее наиболее вероятное, наиболее часто встречающееся расстояние между ближайшими соседями, очень близко совпадает с радиусом первой координационной сферы в твердом состоянии. Первый максимум соответствует первой координационной сфере, максимумы, следующие за первым, выражены слабее, они также представляют расстояния r2, r3.
Большое число исследователей в настоящее время придерживаются мнения, что в жидком состоянии наследуется структура твердого кристалла. Так, жидкое золото имеет так же, как твердое золото, структуру г.ц.к., жидкий калий - о.ц.к., жидкий магний - г.п.у. решетку. С.И.Попель по положению максимумов на кривых радиального распределения 21 металла разделил изученные металлы на две группы.
Первую группу составили металлы Li, Na, К, Fe, Al, Cu, Ni, имеющие в твердом состоянии плотные (г.ц.к., г.п.у. и о.ц.к.) структуры. Для этих металлов при малом перегреве над температурой ликвидуса отношения радиусов сфер r2/r1 = 1,79 - 1,92; r3/r1 = 2,4 - 2,79 и r4/r1 = 3,46 - 3,50. В расплавах этих металлов структурными составляющими являются области с шаровой упаковкой атомов с координационным числом 8 - 10 и межатомными расстояниями r1 , r2 , r3 и зигзагообразные цепочки с межатомными расстояниями r'1; r'1√3; r'1√7; r'1√12; r'1√19 и координационными числами 4 – 2 – 4 – 2. Доля цепочек составляет 80 %. Зигзагообразные цепочки соответствуют расположению атомов в наиболее густонаселенных плоскостях (111) г.ц.к. структуры. Аналогичные микрообразования имеют жидкие металлы с г.п.у. решеткой в твердом состоянии. Только цепочки соответствуют плоскости (100).
Металлы второй группы (Ga, Bi, Sb и др.), обладающие высокой долей ковалентной связи, с рыхлыми кристаллическими решетками типа ромбоэдрической и тетрагональной и низкими координационными числами имеют соотношения r2/r1 = 1,94 - 2,0 и r3/r1 = 2,80-3,0. В расплавах этих металлов структурными составляющими являются области шаровой упаковки, подобные аналогичным областям металлов первой группы, и линейные цепочки атомов с координационным числом 2 - 2 - 2 - 2 и расстояниями r'1; 2r'1; Зr'1. С повышением температуры протяженность цепочек и их доля в расплаве убывают, а доля областей с шаровой упаковкой возрастает.
Однако в настоящее время, как бы ни хотелось нам иметь однозначный взгляд на строение жидкого металла, необходимо признать, что имеется и другая точка зрения, наиболее четко сформулированная П.П.Арсентьевым и Л.А.Коледовым, которые проанализировали большой экспериментальный материал, накопленный к настоящему времени.
Все жидкие металлы, независимо от их кристаллической структуры, в твердом состоянии имеют кривую радиального распределения атомной плотности 4πr2R(r) одного типа. Радиус первой координационной сферы в расплаве равен межатомному расстоянию при плотнейшей упаковке шаров-атомов, диаметр которых принят равным диаметру по Гольдшмидту при координационном числе 12. Отношение радиуса второй к радиусу первой координационной сферы укладывается для всех металлов в узкий интервал значений от 1,8 до 2,0. Величина первого координационного числа лежит в пределах 8-12. Несмотря на большие различия структуры и свойств в твердом состоянии, при плавлении происходит нивелировка характера расположения атомов и отчетливо выраженного качественного различия в строении жидкого металла не наблюдается. В известной мере расплавленный металл "забывает" о той структуре, из которой он образован.
При рассмотрении структуры жидкости необходимо все время считаться с сильной подвижностью частиц в жидкости. Ближайшие соседи в расплаве не находятся на строго фиксированных расстояниях относительно центрального атома. Поэтому расстояние r1max, вычисленное по кривой радиального распределения атомов, не совпадает со средним значением ŕ1 между ближайшими соседями, которое будет больше r1max. Вычисленные величины характеризуются следующими данными:
Металл Ag Аu Сu Ge Pb Sn In
t,оC 1050 1100 1125 1000 375 280 165
r1max, нм 0,288 0,286 0,255 0,270 0,340 0,338 0,317
![]() ,
нм 0,300 0,294 0,266 0,284 0,344 0,346 0,331
,
нм 0,300 0,294 0,266 0,284 0,344 0,346 0,331
С повышением температуры первый и последующий максимумы на кривой радиального распределения сглаживаются, т.е. степень упорядоченности падает. Однако положение первого максимума почти не изменяется, что хорошо показано для олова при изменении температуры от 226 до 1140 °С. Сглаживание максимумов функции радиального распределения отмечает тепловое разрушение ближнего упорядочения вследствие интенсивного перемешивания атомов, находящихся в соседних координационных сферах. При очень больших перегревах за пределами первой координационной сферы устанавливается атомное распределение, соответствующее средней радиальной плотности.
Только тщательные исследования жидких металлов с помощью новейших методик позволят в дальнейшем дать более определенный ответ на вопрос, как расплавленный металл наследует структуру твердого кристалла.
Модельные теории жидкости
В настоящее время существует несколько моделей строения жидкостей, которые с большим или меньшим успехом используются при обсуждении свойств расплавов, вычислении их характеристик в зависимости от содержания легирующих примесей. Ниже кратко остановимся на наиболее употребительных моделях.
Дырочная теория Я.И.Френкеля
При плавлении твердого тела его объем увеличивается примерно на 3 %. Френкель Я.И. предположил, что этот дополнительный объем не распределяется равномерно между всеми частицами жидкости, а проявляется в виде отдельных микрополостей или "дырок". Дырки не являются стабильными образованиями. Из-за теплового движения частиц они могут в некоторых местах пространства возникать, в других исчезать. Там, где дырок нет, расстояние между соседними частицами определяется из функций парного распределения атомной плотности. Средний радиус дырки равен
![]() ,
,
где σ - поверхностное натяжение; k - постоянная Больцмана(1,38·10-23 Дж/К).
В жидком железе при 1873 К σ = 1,7 Дж/м2, однако наиболее вероятное кратчайшее расcтояние между атомами железа в расплаве, определенное дифракционным способом, равно 0,255 нм, т.е. размер дырки в 10 раз меньше межатомного расстояния.
По дырочной
теории тепловое движение атомов сводится
к гармоническим колебаниям частицы
около некоторого положения равновесия
с частотой τo-1.Через
некоторый промежуток времени τ атом
может перескочить в новое положение
равновесия, расположенное по соседству
на расстоянии, близком к межатомному.
Время τ, в течение которого атом
колеблется около положения равновесия,
называется "временем оседлой жизни".
Оно зависит от температуры и энергии
активации образования дырки W:
![]() .
Средняя скорость перемещения атомов
в жидкости равна:
.
Средняя скорость перемещения атомов
в жидкости равна:
![]() ,
где δ - расстояние перемещения. Перескок
атома с одного места на другое и является
самодиффузией атомов. Коэффициент
самодиффузии равен
,
где δ - расстояние перемещения. Перескок
атома с одного места на другое и является
самодиффузией атомов. Коэффициент
самодиффузии равен
![]() .
.
Период колебаний атомов τo в положении равновесия оценивается величиной 10-13 – 10-14 с. Г.Н.Еланский рассчитал для сплава Fe - 2,5 % С при 1350 °С энергию активации самодиффузии 65,8 кДж/моль, τo = 10-14 с и τ = 1,3·10~12 с. В твердом состоянии энергия активации самодиффузии железа равна 350 кДж/моль, τo = 10-14 с, τ=2,7-10-12 с при 1273 К.
Теория кластеров или сиботаксисов
Эта теория была предложена в 1927 г. Стюартом и Морри. При плавлении твердое тело распадается на более или менее крупные группировки частиц, обладающие известным структурным однообразием. Эти группы частиц сохраняют особенности строения кристаллической решетки твердого тела. Такие группировки называют сиботаксисами, роями или кластерами. Они не имеют четко выраженных границ, непрерывно образуются и разрушаются. Атомы переходят из одного кластера в другой. В объеме, разделяющем кластеры, частицы расположены беспорядочно. Вся система в целом будет гомогенной, так как кластер не имеет физической границы раздела, при переходе через которую параметры состояния и свойства менялись бы скачкообразно. Кластер характеризует структуру данной жидкости и не может считаться представителем другой фазы.
В сплавах или растворах нескольких компонентов кластеры могут составляться из однородных атомов типа АА или разнотипных атомов АВ. В бинарном растворе могут иметь место кластеры типа: АА, ВВ, АВ. Тогда какое-нибудь свойство расплава Ф можно определить по уравнению:
Ф=ФANA +ФBNB +ФKNAnNB,
где ФА и Фв - свойства чистых компонентов; Ni - атомная доля; Фк - приведенный вклад в свойство кластера АnВ, n - индекс приведенного кластера, характеризующий соотношение атомов А и В в кластере АnВ. Для сплавов палладия с Ni, Co, Cu, Fe, Ag поверхностное натяжение, молярный объем, электропроводность хорошо описывались данным уравнением при индексе n = 0,4, Но в той же системе могут быть кластеры и другого состава: A2B'5, А4В10 и т.п.
Модель жестких сфер
Жидкость уподобляется массе частиц - шаров, которые занимают определенный объем с непроницаемыми стенками. Шары несжимаемы и не могут приблизиться друг к другу на расстояние, меньшее их диаметра. Принимается, что шары невесомые, плотность размещения шаров в пространстве одинакова.
Модель имеет три важных параметра - характеристики:
