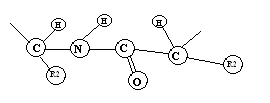
Особенности строения полипептидной цепи: - атомы - N – С – С –, которые составляют основную полипептидную цепь располагается зигзагообразно; - R аминокислот, атомы «Н» аминогруппы, атом «О» карбонильной группы находятся относительно друг друга в регулярном транс-положении; - атомы «Н» и R у α – углеродного атома располагаются под углом 109028/; - пептидная связь имеет особый характер что подтверждается фактами: 1. длина связи - С - N = 0,1325 нм, что является средним между «- и «=» связью 2. все, входящие в состав пептидной группировки атомы, располагаются в одной плоскости такая конформация, называется планарной - остов основной полипептидной цепи окружен разнообразными по своей химической природе боковыми цепями, данные цепи (R) функциональны многолики !* молекулы белков имеют несколько уровней структурной организации: первичная, вторичная, третичная и четвертичная структуры Первичная структура – последовательность аминокислот !!! выяснена у 2000 белков
|
Вторичная структура – спираль за счет водородных связей Н \ / С = О и : N / \
Полипептидная цепь в молекулах подавляющего числа белков свернута в виде правозакрученной спирали - α – спираль, с предельно плотной упаковкой цепи, в которой радикалы аминокислотных остатков направлены всегда наружу !* α – спираль характеризуется параметрами: - шаг спирали = 0,54 нм - угол подъема спирали 260 - период идентичности = 2,7 нм (18 аминокислотных остатков) !!! - водородные связи – придают жесткость и устойчивость спиральной цепи - π – сопряжение – СО – и –NН – при участии водородной связи создает макромолекулярную квазисопряженную структуру |
Третичная структура – конфигурация спирали !* - взаимодействие - NH2, - ОН, - СООН групп, не участвующих в образовании пептидной связи
!* важная роль в поддержании третичной структуры принадлежит: - дисульфидным связям - силам слабых взаимодействий (водородные связи, электростатическое взаимодействие, гидрофобное взаимодействие неполярных радикалов) !* третичная структура возникает автоматически, движущей силой при этом является взаимодействие аминокислотных остатков с молекулами окружающего растворителя Четвертичная структура !* более крупные образования между агрегатами, объединенными третичной структурой, связываются между собой водородной связью и гидрофобным взаимодействием !* выяснена у нескольких сотен белков, например, гемоглобин
|
!* чаще всего денатурация необратима, но если устранить денатурирующий агент может произойти ренатурация Денатурирующие агенты: 1. высокая Т0 ( разрыв водородных и гидрофобных связей) 2. кислоты, основания (разрыв электростатических взаимодействий) 3. органические растворители (разрыв гидрофобных связей) 4. мочевина, гуанидин (разрыв водородных связей) 5. соли тяжелых металлов 6. ультрафиолетовое излучение !* при денатурации не разрушаются ковалентные связи, первичная структура, а => химический состав не изменяется, изменяются только физические свойства: уменьшается Р, способность к гидратации, теряется биологическая активность - способность образовывать студни (при набухании белков в воде) Характеристика студней: 1.не текучи 2. упругость 3. пластичность 4. механическая прочность 5.способность сохранять форму - пенообразование !* высококонцентрированные системы «Ж - ↑» - пены !* устойчивость пены, в которой белок является пенообразователем, зависит не только от его природы и концентрации, но и от температуры |
5. Химические свойства. 1. Гидролиз – основное свойство. О Н О Н ║ │ ║ │ NH2 -СН - С – N – СН – С – N - … + n Н2О→ NH2 -СН - СООН + │ │ │ R1 R2 R1
+ NH2 – СН – СООН !* среда кислая (Н +) , щелочная (ОН -) │ R2 |
|
4.Физические свойства белков. - агрегатные состояния: Ж (молоко, кровь); Т (шерсть, когти); полужидкое (яйца) - растворимые белки при нагревании 70-800С свертываются (денатурируют) => способность связывать воду уменьшается, теряется часть влаги !* молекула денатурированного белка неупорядочена, она приобретает характер статического клубка, => белок теряет функциональную активность |
O H O H ║ │ ║ │ H2N – CH2 – C – N – CH – C – N – CH - COOH + H2O → ↑ ↑ │ ↑ ↑ │ HO – H CH2 HO – H CH2 │ │ OH SH трипептид (гли-сер-цис) → H2N – CH2 – COOH + NH2 – CH – COOH + NH2 – CH – COOH глицин │ │ CH2 CH2 │ │ OH SH серин цистеин !* в организме животных и человека происходит гидролиз белков под влиянием ферментов (пепсина, трипсина и др.), при этом аминокислоты попадают в кровь и поступают в ткани и клетки организма, где образуются необходимые организму белки 2. Горение. !* З (жженые перья) белок + О2 → N2 + СО2↑ + Н2О + другие вещества 3. Качественные реакции на белок. - ксантопротеиновая реакция (взаимодействие ароматических и гетероатомных циклов) Т0 NН3 белок + НNО3 (конц) → желтая окраска → оранжевая окраска - биуретовая окраска (наличие пептидных связей в молекуле) белок + Cu(OH)2 → фиолетово – синяя окраска
|
- строение фермента рибонуклеазы, состоящей из 124 аминокислотных остатков - работы Дю-Виньо – изучение гормонов гипофиза белковой природы (синтезирован в 1954г): вазопрессин – изменяющий кровяное давление, окситоцин – действующий на мышцы матки состоят из 9 аминокислотных остатков; различаются строением лишь двух аминокислот – изолейцин и лейцин окситоцина в вазопрессине заменены на фенилаланин и аргинин Окситоцин: __________ S – S ___________ │ NH2 NH2 │ │ │ цис-тир-и- лейцил-глут-асп-цис-прол-лейцил-глут- NH2 - NH – CH – C - - NH – CH – C - │ ║ │ ║ H3C – CH O CH2 O │ │ CH2 CH │ / \ CH3 H3C CH3 Вазопрессин: ___________ S – S _____________ │ NH2 NH2│ │ │ Цис-тир-фенилаланил-глут-асп-цис-прол-аргинил-глут-NH2 - NH – CH – C - - NH – CH – C - │ ║ │ ║ СН2 О (СН2)3 О │ │ С6Н5 NH – С – NH2 ║ NH - заболевание серповидная клеточная анемия – изменение строения молекулы белка – гемоглобина: из 300 аминокислотных остатков гемоглобина заменяется лишь один, а именно на место глутаминовой кислоты встает нейтральный валин |
6.Связь между строением и биологической активностью белковых молекул. - 1954г – установлена первичная структура гормона инсулина, который регулирует содержание сахара в крови; молекула инсулина состоит из двух полипептидных цепей: в одной – 21 аминокислотный остаток, а в другой – 30 аминокислотных остатков - 1942г Гаузе – открытие антибиотика - грамицидина С, позднее в 50-х годах было выяснено строение полипептида |
Углеводы. Глоссарий.
|
|