
- •Характерные и специфические реакции катионов марганца.
- •Характерные и специфические реакции катионов магния.
- •Характерные и специфические реакции катионов висмута.
- •Характерные и специфические реакции катионов сурьмы.
- •1) Раствором nh4Cl
- •2) Разбавленной азотной кислотой (растворение Fe(oh)3, Bi(oh)3) центрифугированием
- •3) Соляной кислотой
- •Дробный ход анализа катионов пятой аналитической группы.
- •Вопросы для самостоятельной работы.
Характерные и специфические реакции катионов магния.
Реакция на катионы магния с оксихинолином.
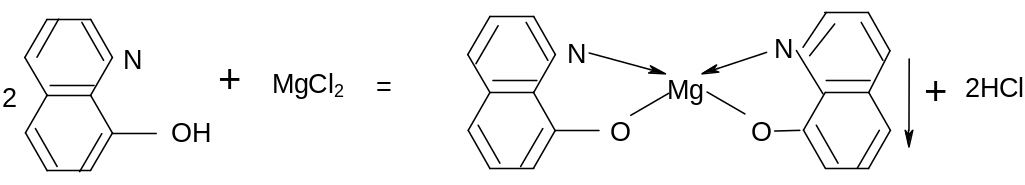
Оксихинолят магния – осадок кристаллический зеленовато – желтого цвета выпадает из аммиачных растворов. Выполнение реакции. К 1мл раствора магниевой соли приливает равный объем NH4OH, затем NH4Cl раствор хлорида аммония до полного растворения осадка Mg(OH)2 и несколько капель оксихинолина.
2. Дифенилкарбазид с катионами магния в щелочном растворе образует внутрикомплексную соль красно – фиолетового цвета.
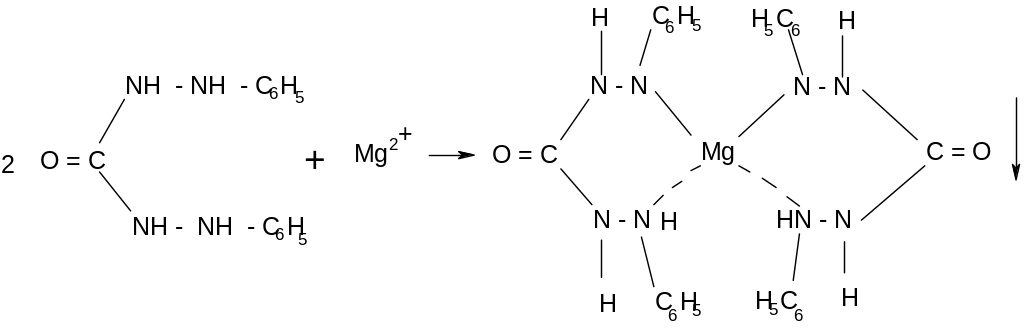
Выполнение реакции. К 2-3 каплям исследуемого раствора, не содержащего солей аммония, приливают 2-3 капли 2н раствора щелочи натрия NaOH и 2-3 капли раствора дифенилкарбазида, нагревают смесь до кипения, отделяют осадок центрифугированием, осадок промывают горячей дистиллированной водой до тех пор, пока промывные воды не станут бесцветными. В присутствии магния Mg2+ осадок будет красно – фиолетового цвета. Дифенилкарбазид реагирует не только с растворимыми солями магния, но и с карбонатом, оксидом, фосфатом и др. нерастворимыми его солями. Поэтому этот реактив может быть применен и для открытия магния в осадке.
Для этого исследуемый осадок обливают горячим спиртово-щелочным раствором дифенилкарбазида. Затем осадок промывают горячей дистиллированной водой, как указано выше. В присутствии магния Mg2+ осадок приобретает красно-фиолетовый цвет.
3. Магнезон I или магнезон II в щелочной среде дают красную или красно-фиолетовую окраску. Эта реакция основана на свойстве гидроксида магния Mg(OH)2 адсорбировать некоторые красители.
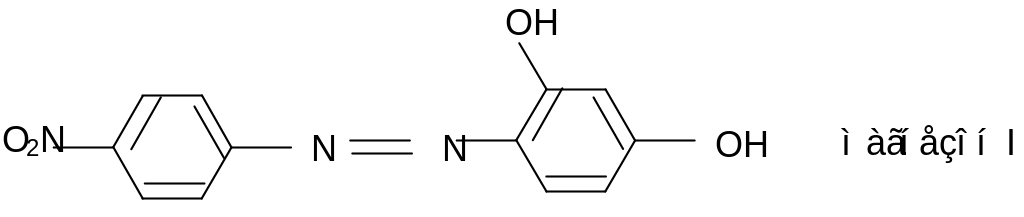
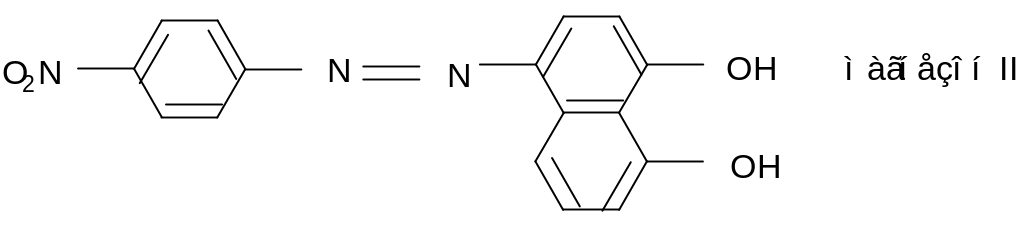
Выполнение реакции. На фарфоровую пластинку (предметное стекло) поместить 1-2 капли анализируемого раствора на Mg2+, добавить 2 капли щелочного раствора реактива. Появляется синяя окраска или синий осадок, если реакция кислая, то появится желтая окраска, в данном случае к раствору нужно добавить несколько капель щелочи.
Дитизон (дифенилтиокарбазон)
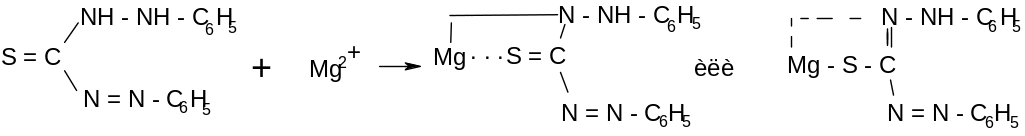
Характерные и специфические реакции катионов висмута.
1. Восстановление катионов висмута Bi3+ до металлического.
а) К свежеприготовленному раствору хлорида олова SnCl2 приливают щелочь калия или натрия NaOH, KOH до растворения образующегося в начале осадка Sn(OH)2:
SnCl2 + 2NaOH = Sn(OH)2↓ + 2NaCl
Sn(OH)2↓ + 2NaOH = Na2[Sn(OH)4] - раствор тетрагидроксостаннат(II) натрия. Затем к полученному раствору Na2[Sn(OH)4] приливают испытуемый раствор, если в результате образуется осадок черного цвета, указывает на наличие катионов Bi3+:
3 Na2[Sn(OH)4] + 2BiCl3 + 6NaOH = 3 Na2[Sn(OH)6]2 + 2Bi0↓ + 6NaCl
B i3+ + 3e → Bi0 2
 [Sn(OH)4]2-
+
2OH-
-
2e → [Sn(OH)6]2-
3
[Sn(OH)4]2-
+
2OH-
-
2e → [Sn(OH)6]2-
3
3[Sn(OH)4]2- + 2OH- + 2Bi3+ → 3[Sn(OH)6]2- + 2Bi0
Со щелочным раствором хлорида олова SnCl2 остальные катионы пятой группы также дают осадки соответствующих гидроксидов, но они имеют белую и бурую окраску. Если в растворе имеется высокая концентрация катионов железа Fe3+, осадок которого имеет темно-бурый цвет, будет мешать открытию катионов висмута. Катионы трехзарядного железа Fe3+ из раствора удаляют.
б) Восстановление катионов висмута Bi3+можно проводить металлическим алюминием, цинком, железом. Для этого берут пластинки из соответствующих металлов. Пластинку очищают наждачной бумагой и на очищенное место наносят несколько капель подкисленного соляной кислотой HCl анализируемого раствора. При наличии в растворе катионов висмута через несколько минут появляется под каплей черное пятно металлического висмута Bi:
3Zn + 2BiCl3 = 3ZnCl2 + 2Bi
Этой реакции мешают катионы сурьмы и ртути.
2. Реакция висмута катионов Bi3+ с иодидом калия KJ.
При действии небольшого количества иодида калия KJ на катионы висмута Bi3+ образуется осадок черного цвета BiJ3↓:
BiCl3 + 3KJ = BiJ3↓ + 3KCl
При избытке иодида калия KJ раствор принимает красновато-желтый цвет (образование комплексной соли K[BiJ]4)
BiJ3↓ + KJ = K[BiJ]4)
Из катионов пятой группы открытию висмута Bi3+ иодидом калия мешают катионы железа Fe3+, т.к. они окисляют иодид-ион до J2, который окрашивает раствор в коричневый цвет, но катионы железа Fe3+ из раствора можно удалить восстановлением их до Fe2+щавелевой кислотой. Из других групп открытию висмута мешают ионы ртути, серебра, свинца и меди.
3. Дихромат калия в присутствии ацетатного буферного раствора осаждает катионы висмута Bi3+в виде желтого осадка дихромата висмутила (BiO)2Cr2O7
2BiCl3 + K2Cr2O7 +2H2O + 4CH3COOK = (BiO)2Cr2O7↓ + 6KCl + 4CH3COOH
Дихромат висмутила растворяется в минеральных кислотах, но не растворяется в растворах щелочей (отличие от свинца).
