
- •Подставляя это выражение в (11), получим
- •Разделив полученное выражение на cvpdV и введя обозначение , получим
- •Характеристики измерительных приборов
- •Описание экспериментальной установки и вывод расчётных формул
- •Решая систему уравнений (14) и (16), получим
- •Расчёт погрешностей
- •Контрольные вопросы
- •Первое начало термодинамики математически записывается в виде
- •Подставляя это выражение в (11), получим
- •Разделив полученное выражение на cvpdV и введя обозначение , получим
Министерство транспорта Российской Федерации
Федеральное агентство морского и речного транспорта
Федеральное государственное образовательное учреждение
высшего профессионального образования
ГОСУДАРСТВЕННАЯ МОРСКАЯ АКАДЕМИЯ
имени адмирала С.О. Макарова
филиал в городе Архангельске
АРКТИЧЕСКИЙ МОРСКОЙ ИНСТИТУТ
имени В.И. Воронина
ЛАБОРАТОРНАЯ РАБОТА № 106
по курсу Физики
Показатель адиабаты
Выполнила:
студент 1 курса АМИ
Данилюк Дмитрий Юрьевич
№ зачетной книжки: А- 8126674
Проверил: В. Э. Махин
Архангельск 2012
ЛАБОРАТОРНАЯ РАБОТА № 106
ОПРЕДЕЛЕНИЕ ПОКАЗАТЕЛЯ АДИАБАТЫ
Цель работы: экспериментальное определение показателя адиабаты = Cp/CV для воздуха.
Теоретические положения
Первое начало термодинамики математически записывается в виде
Q = dU + A, (1)
где Q – теплота, сообщаемая системе; dU – изменение внутренней энергии системы; A – работа, совершенная системой в процессе.
Важнейшими тепловыми характеристиками однородных тел являются их удельная c и молярная C теплоёмкости. Удельная теплоёмкость тела равна количеству теплоты, необходимому для изменения температуры 1 кг тела на 1 К:
![]() . (2)
. (2)
Единица измерения удельной теплоёмкости тела Дж/(кгК).
Молярной теплоёмкостью называется физическая величина C, численно равная теплоте, которую нужно сообщить 1 молю вещества для изменения его температуры на 1 К:
![]() ,
(3)
,
(3)
где = m/ - количество вещества, моль; - молярная масса, кг/моль. Единица измерения молярной теплоёмкости Дж/(мольК).
Теплоёмкость вещества зависит от процесса, в котором теплота подводится к веществу. Различают теплоёмкости при постоянном объёме CV и постоянном давлении Cp, если процесс подвода теплоты осуществляется соответственно в изохорном (V = const) и изобарном (p = const) процессах.
Работа A, совершаемая системой против внешних сил:
A = pdV . (4)
Выражение для количества теплоты получим из (3):
![]() .
(5)
.
(5)
Подставив (4) и (5) в (1), получим первое начало термодинамики в виде:
![]() (6)
(6)
В изохорном (V = const) процессе газ не совершает работы, следовательно, A = pdV = 0. Отсюда получаем, что согласно первому началу термодинамики в изохорном процессе вся теплота, сообщаемая системе, идет на изменение его внутренней энергии:
![]() .
(7)
.
(7)
Молярная теплоёмкость вещества при постоянном объёме CV зависит от температуры T. В узком диапазоне изменения температур для реальных газов обычно принимают CV const. Изохорная теплоёмкость идеального газа от температуры не зависит: CV = const.
Внутренняя энергия реального газа U представляет собой сумму кинетической энергии теплового движения молекул и потенциальной энергии их взаимодействия, которая зависит от среднего расстояния между молекулами и, следовательно, изменяется вместе с объёмом газа V.
Согласно определению идеального газа его молекулы не взаимодействуют между собой. Поэтому потенциальная энергия взаимодействия молекул равна нулю и внутренняя энергия идеального газа равна энергии теплового движения молекул и не зависит от объёма газа. Таким образом, внутренняя энергия идеального газа зависит лишь от температуры, массы и строения молекул газа (числа степеней свободы молекулы i). Отсюда вытекает, что соотношение (7) справедливо для любого процесса, происходящего с идеальным газом.
Рассмотрим изобарный процесс (p = const). По аналогии с (7) можно записать
![]() ,
(8)
,
(8)
где Cp - молярная теплоёмкость при постоянном давлении (изобарная теплоёмкость). Используя (4) и уравнение Клапейрона-Менделеева для вывода формулы работы в изобарном процессе, получим
![]() .
(9)
.
(9)
Подставим уравнения (7) – (9) в (1) и получим выражение для первого начала термодинамики в следующем виде:
![]() .
.
Или после сокращения
Cp - CV = R. (10)
Полученное выражение называется уравнением Майера. Для удельных теплоёмкостей cp и cV оно принимает вид
![]() .
.
Из уравнения Майера следует, что изобарная теплоёмкость всегда больше изохорной. Причём разность теплот, затрачиваемых на изобарное и изохорное нагревание равных количеств газа равна работе, совершённой этим количеством газа при изобарном расширении. Преобразовав уравнение (9) к виду
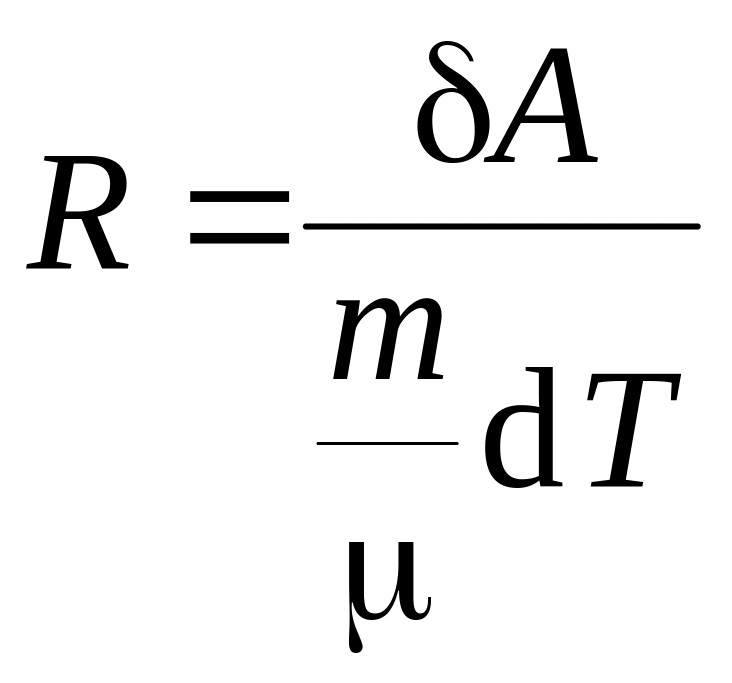 ,
,
приходим к выводу, что универсальная газовая постоянная R численно равна работе изобарного нагревания 1 моль идеального газа на 1 К.
Адиабатным называется процесс, протекающий без теплообмена с окружающей средой (Q = 0). Первое начало термодинамики для адиабатного процесса можно записать в виде
![]() .
(11)
.
(11)
Дифференцируя уравнение Клапейрона-Менделеева получим
![]()
или
![]()
![]() .
.
Подставляя это выражение в (11), получим
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
После сокращения на R и принимая во внимание (10), получим
Cp pdV + CVVdp = 0 .
Разделив полученное выражение на cvpdV и введя обозначение , получим
![]() .
(12)
.
(12)
Безразмерная величина называется показателем адиабаты или коэффициентом Пуассона.
Интегрируя уравнение (12), имеем
lnV + lnp = lnconst
или pV = const .
Это выражение называется уравнением Пуассона или уравнением адиабатного процесса. Используя известные соотношения между параметрами состояния идеального газа, уравнение Пуассона можно также привести к виду
![]() или
или
![]() .
.
Из теории теплоёмкостей идеального газа известны соотношения
![]() и
и
![]() ,
,
где i – число степеней свободы молекулы. Разделив первое уравнение на второе, получим расчетное соотношение для коэффициента Пуассона:
![]() .
(13)
.
(13)
Характеристики измерительных приборов
Манометр 20 делений
Описание экспериментальной установки и вывод расчётных формул
Экспериментальная установка (рис. 1) включает в себя стеклянный баллон 1, наполненный воздухом. Баллон соединён с жидкостным манометром 2 и грушей-помпой 3. Через вентиль 4 баллон может быть соединён с помпой и атмосферой. Таким образом, манометр показывает избыточное давление воздуха в баллоне в сравнении с атмосферным. Если полностью открыть вентиль, то процесс выравнивания давления в баллоне с атмосферным давлением происходит достаточно быстро. В этом случае количеством теплоты, которое успевает передать воздух в баллоне окружающей среде, можно пренебречь ввиду её малости и с достаточной точностью считать процесс расширения воздуха в баллоне адиабатным.
h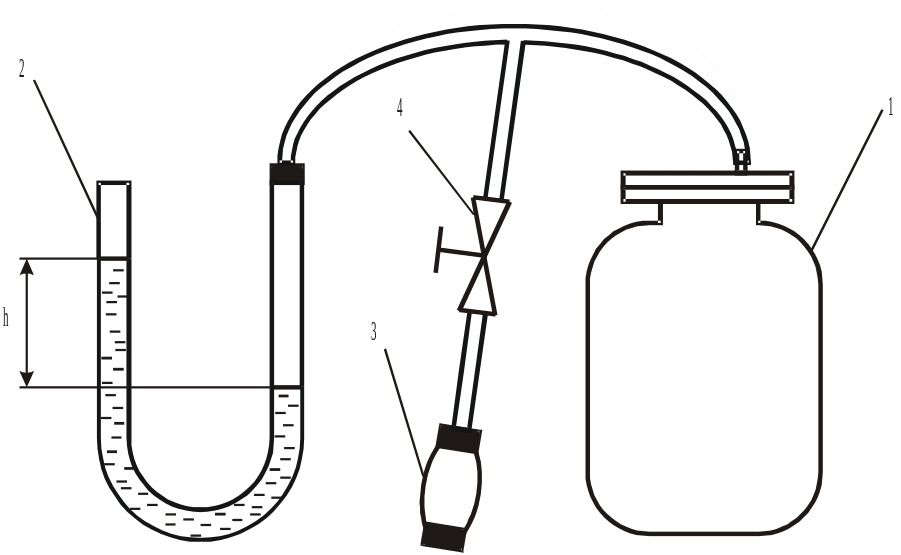
Рис. 1
Накачаем воздух в баллон помпой 3 и закроем вентиль. Нагнетание воздуха в баллон представляет собой изохорный процесс сжатия, сопровождающийся увеличением температуры воздуха в баллоне выше комнатной. При этом работа, совершаемая помпой, переходит во внутреннюю энергию воздуха. После закрытия вентиля в течение нескольких минут температура воздуха в баллоне сравнивается с комнатной. Давление воздуха в баллоне p1 при этом равно
p1 = p0 + p = p0 + gh1 ,
г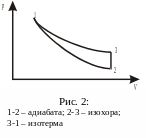 де
p0
– атмосферное давление, Па; p
– избыточное давление воздуха,
показываемое манометром, Па; g
= 9,81 м/с2
– ускорение свободного падения;
= 1000 кг/м3
– плотность манометрической жидкости
(воды); h1
– разность уровней жидкости в манометре
при давлении p1.
де
p0
– атмосферное давление, Па; p
– избыточное давление воздуха,
показываемое манометром, Па; g
= 9,81 м/с2
– ускорение свободного падения;
= 1000 кг/м3
– плотность манометрической жидкости
(воды); h1
– разность уровней жидкости в манометре
при давлении p1.
Выберем мысленно в сосуде объём V. Будем считать, что число молекул в этом «объёме» неизменно. Начальное состояние воздуха в «объёме» характеризуется параметрами p1, V1, T1 (рис.2).
Если открыть полностью вентиль и закрыть его в тот момент, когда давление воздуха в баллоне сравняется с атмосферным, то выбранный нами «объём» при этом увеличится до значения V2, а температура воздуха в баллоне понизится до значения T2, так как при своём расширении воздух совершает работу против атмосферного давления. Итак, в момент закрытия вентиля параметры воздуха в «объёме» p2, V2, T2. Считая процесс перехода из состояния 1 в состояние 2 адиабатным, можем записать
![]() .
(14)
.
(14)
После закрытия вентиля в баллоне изохорный процесс теплообмена с окружающей средой, в котором температура воздуха постепенно приближается к комнатной T1, а давление по окончании этого процесса становится равным
p = p0 + p = p0 + gh2 , (15)
где p – избыточное давление по манометру при выравнивании температур. Параметры состояния воздуха после окончания изохорного процесса будут p3, T1, V3, причём V3 = V2.
Так как температуры воздуха в первом и третьем состоянии одинаковы, а число молекул в выбранном нами «объёме» постоянно, то для состояний 1 и 3 можно записать в соответствии с законом Бойля-Мариотта:
p1V1 = p3V3 = p3V2 . (16)
