
Порядок выполнения работы.
1. Приготовление раствора уксусной кислоты.
Используя бюретки объемом 50 - 100 мл, приготавливают в шести нумерованных конических колбах объемом 50 мл растворы уксусной кислоты различной концентрации. Растворы приготавливают в соответствии с таблицей 1.
Таблица №1
№ раствора |
1 |
2 |
3 |
4 |
5 |
6 |
Объем исходного раствора CH3COOH мл |
50 |
35 |
25 |
15 |
10 |
7 |
Объем H2O мл |
0 |
15 |
25 |
35 |
40 |
43 |
Общий объем раствора мл |
50 |
50 |
50 |
50 |
50 |
50 |
Из полученных растворов пипеткой Мора отбирают 25 мл и переносят в другую серию конических колб. Растворы отбирают, начиная с меньшей концентрации, используя одну пипетку. В растворы первой серии помещают по 1 г активированного угля (взвешивание производят на технических весах с использованием часового стекла).
Колбы, содержащие растворы с активированным углем, закрывают притертыми пробками и выдерживают в течение 1-1,5 час, периодически перемешивая. Концентрацию уксусной кислоты в исходных растворах и растворах после адсорбции определяют титрованием щелочью в присутствии фенолфталеина.
Для титрования отбирают по 5 мл раствора. (Титрование рекомендуется начинать с меньших концентраций CH3COOH и проводить до 3-х сходящихся результатов). Целесообразно к раствору перед титрованием добавить по 10 мл воды и 2-3 капли фенолфталеина. Отбор растворов производится нумерованными пипетками Мора на 5 мл, при чем номер пипетки должен соответствовать номеру раствора. Перед началом работы всю используемую посуду необходимо тщательно вымыть.
Оформление работы.
Результаты работы представляют в виде следующих таблиц.
Таблица 2.
Определение концентрации уксусной кислоты до адсорбции.
№ раствора |
1 |
2 |
3 |
4 |
5 |
6 |
Объем щелочи, израсходованной на титрование, мл (до 3-х сходящихся результатов). |
|
|
|
|
|
|
Концентрация кислоты до адсорбции С1; моль/л |
|
|
|
|
|
|
Таблица 3.
Определение концентрации уксусной кислоты после адсорбции.
№ раствора |
1 |
2 |
3 |
4 |
5 |
6 |
Объем щелочи, израсходованной на титрование, мл (до 3-х сходящихся результатов). |
|
|
|
|
|
|
Концентрация кислоты после адсорбции С2 моль/л |
|
|
|
|
|
|
Таблица 4.
Зависимость адсорбции от концентрации уксусной кислоты.
m = m ( C )
№ раствора |
1 |
2 |
3 |
4 |
5 |
6 |
С2 |
|
|
|
|
|
|
С1 – С2 |
|
|
|
|
|
|
m |
|
|
|
|
|
|
Адсорбцию m вычисляют по формуле:
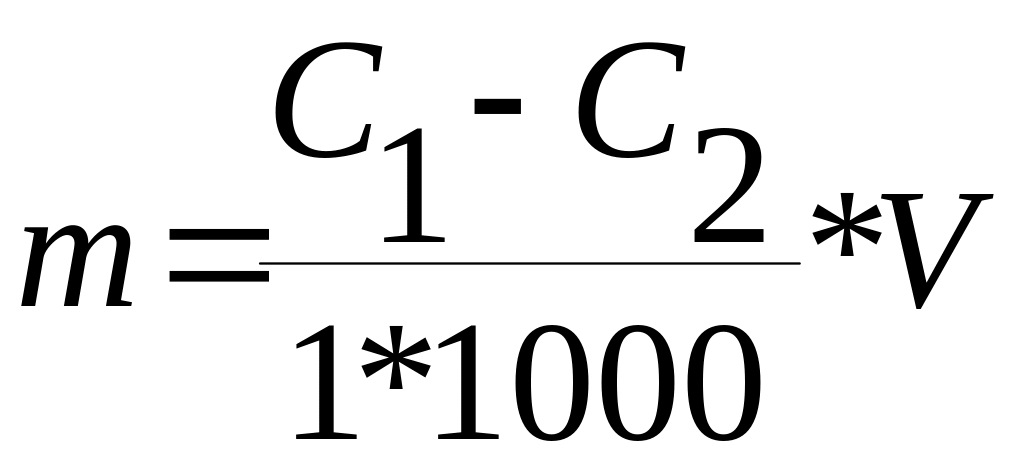
где: V – объем исследуемого раствора мл.
Таблица 5.
Зависимость обратной адсорбции от обратной концентрации.
(Данные для спрямленной изотермы Ленгмюра).
№ раствора |
1 |
2 |
3 |
4 |
5 |
6 |
1/C2 |
|
|
|
|
|
|
1/m |
|
|
|
|
|
|
Экспериментальные данные представляют также в виде следующих графиков:
1. Зависимость адсорбции от концентрации уксусной кислоты (Изотерма Ленгмюра), m = m (C2),
2. Спрямленная изотерма Ленгмюра (в координатах 1/m, 1/C2) Величину m∞ можно найти из последнего графика. Однако в связи с тем, что наблюдается значительный разброс зкспериментальных точек, величину вычисляют как постоянную уравнения.
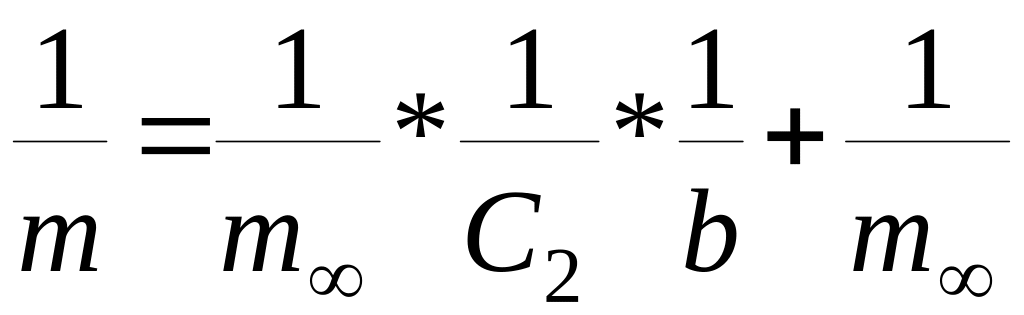
С этой целью применяют метод наименьших квадратов Гаусса. В основе этого метода лежит требование, чтобы сумма квадратов погрешностей была минимальной. На основе этого требования в случае, если зависимость описывается уравнением типа: y = ax + b для определения коэффициентов "a" и "b" составляется система линейных уравнений:
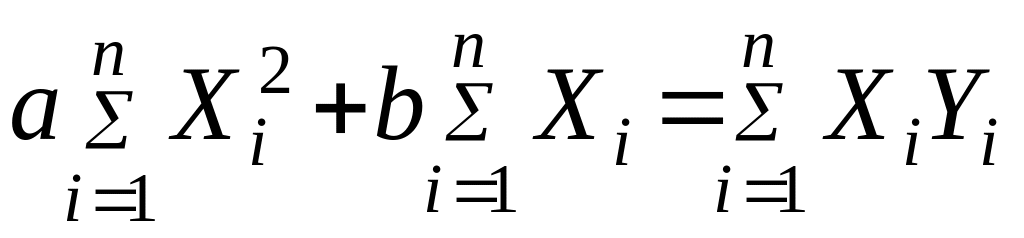
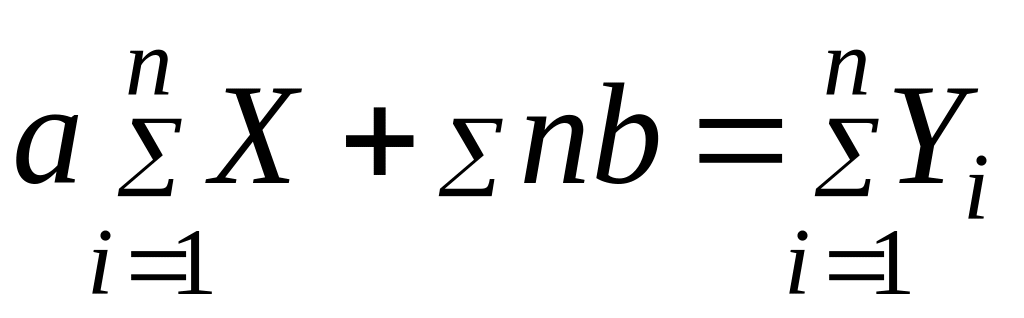
где:
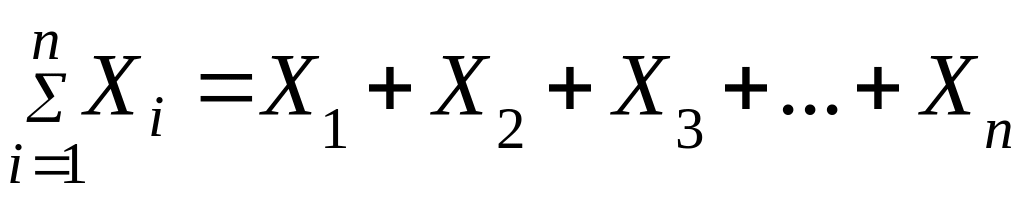 -
сумма всех значений величины X.
-
сумма всех значений величины X.
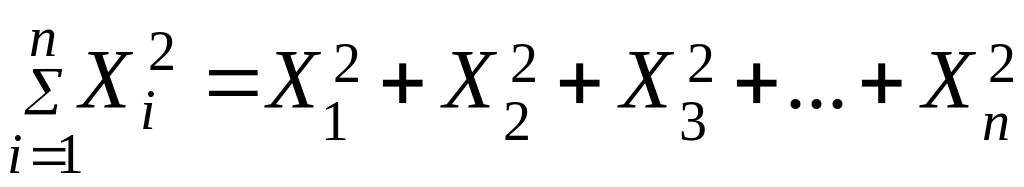 -
сумма квадратов всех значений величины
X.
-
сумма квадратов всех значений величины
X.
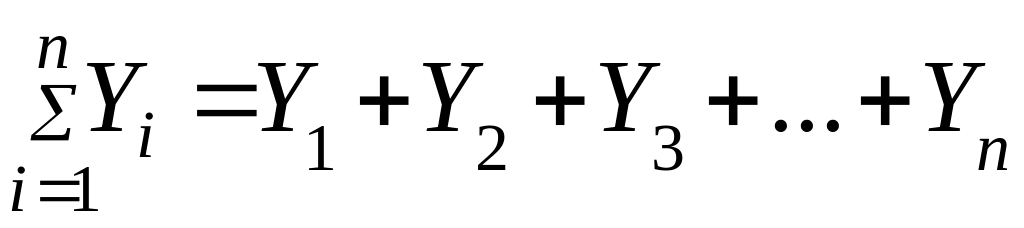 -
сумма всех значений величины Y.
-
сумма всех значений величины Y.
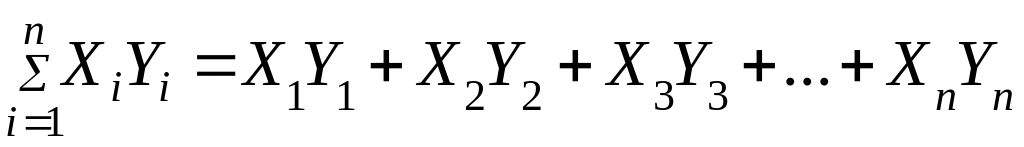 -
сумма всех произведений X
и Y
-
сумма всех произведений X
и Y
n – число экспериментальных точек.
Решая систему этих уравнений, находят коэффициенты "a" и "b".
Применение метода поясним следующим примером:
В таблице приведены значения величины Х и соответствующие им значения величины Y:
№ |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
X |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
Y |
2,7 |
4,3 |
4,6 |
6,3 |
6,6 |
8,3 |
8,7 |
10,3 |
10,6 |
12,4 |
12,8 |
14,2 |
14,8 |
Для нахождения коэффициентов уравнения y = ax + b результаты необходимых расчетов приведем в виде таблицы:
X |
Y |
X2 |
XY |
1 |
2,7 |
1 |
2,7 |
2 |
4,3 |
4 |
8,6 |
3 |
4,6 |
9 |
13,8 |
… |
… |
… |
… |
11 |
12,8 |
121 |
140,8 |
12 |
14,2 |
144 |
170,4 |
13 |
14,8 |
169 |
192,8 |
91 |
116,6 |
819 |
999,8 |
Для данного примера система уравнений приобретает вид:
819*a + 918 = 999,8
81*a + 14*b = 116,6
Отсюда: a = 1,0; b = 1,9
Для вычисления m составляют следующую таблицу:
№ |
1/С2 |
(1/С2)2 |
1/m |
(1/m)*C2 |
X |
X2 |
Y |
XY |
|
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
|
4 |
|
|
|
|
5 |
|
|
|
|
6 |
|
|
|
|
Независимой переменной Х является величина 1/ С2, а функцией Y - 1/m. По полученному значению 1/m∞ и угловому коэффициенту построить спрямленную изотерму Ленгмюра.
Принимая площадь, приходящуюся на одну молекулу CH3COOH равной 2,1*10-20 м2, рассчитывают по формуле:
![]()
