
Определение удельной поверхности адсорбента
Определение удельной поверхности адсорбента.
В последнее время все более широкое применение в медицине находят методы экстракорпоральной детоксикации организма, используемые при многих патологических состояниях организма. Такие методы обработки биологических жидкостей (крови, плазмы, лимфы) основаны на способности многих веществ адсорбироваться на поверхности раздела фаз.
Адсорбция - процесс самопроизвольного концентрирования поверхностно активных веществ в поверхностном слое в результате перехода его из объема фазы.
Поверхностно активные вещества обладают двойственной дифильной природой. Молекулы их состоят из полярной части, хорошо взаимодействующей с водой - это группы -COOH, -COO , -OH , -SO3H, -NH2, и т.д. (гидрофильная часть молекулы), и неполярного углеводородного радикала (гидрофобная часть).
Поверхность раздела фаз характеризуется особым энергетическим состоянием атомов и молекул, находящихся на границе раздела. Это энергетическое состояние характеризуется избытком свободной поверхностной энергии.
Граница раздела жидкость - газ характеризуется поверхностным натяжением. Его можно определить как частную производную любой характеристической функции по площади раздела фаз при соответствующих постоянных:
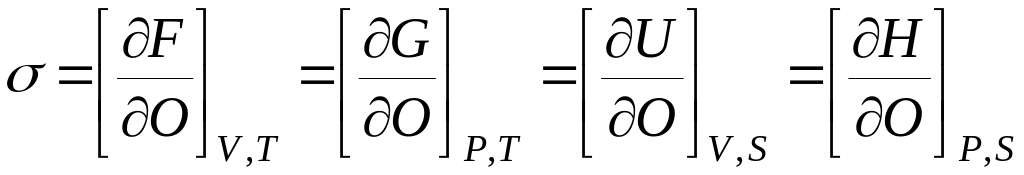
Все функции и параметры относятся к системе в целом.
Из данного
определения следует, что
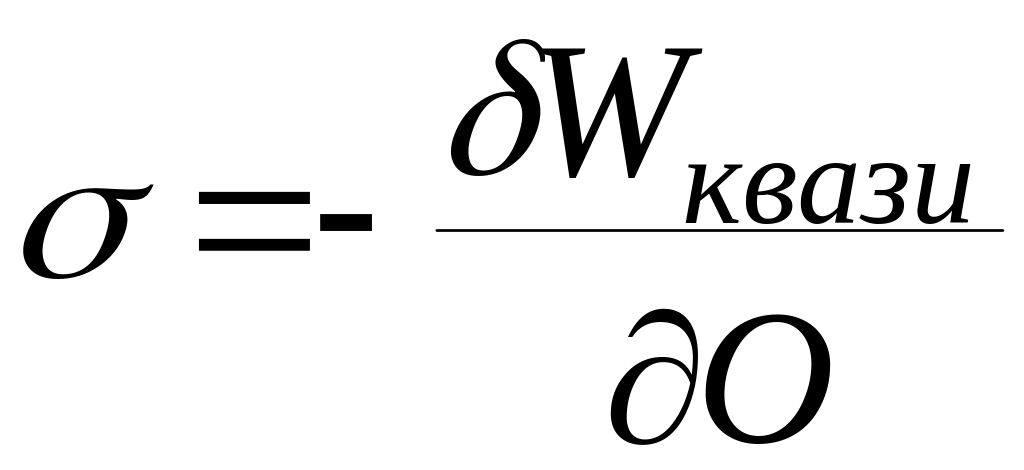
Граница раздела фаз жидкость - жидкость характеризуется межфазным натяжением, твердое - газ кристаллоповерхностным давлением.
Адсорбция поверхностноактивных веществ (ПАВ) приводит к снижению избытка свободной поверхностной энергии - переходу системы в состояние с меньшей поверхностной энергией.
Для адсорбции наиболее часто используют твердые адсорбенты, и самой важной характеристикой их является удельная поверхность - величина поверхности раздела фаз, приходящаяся на единицу массы или объема адсорбента.
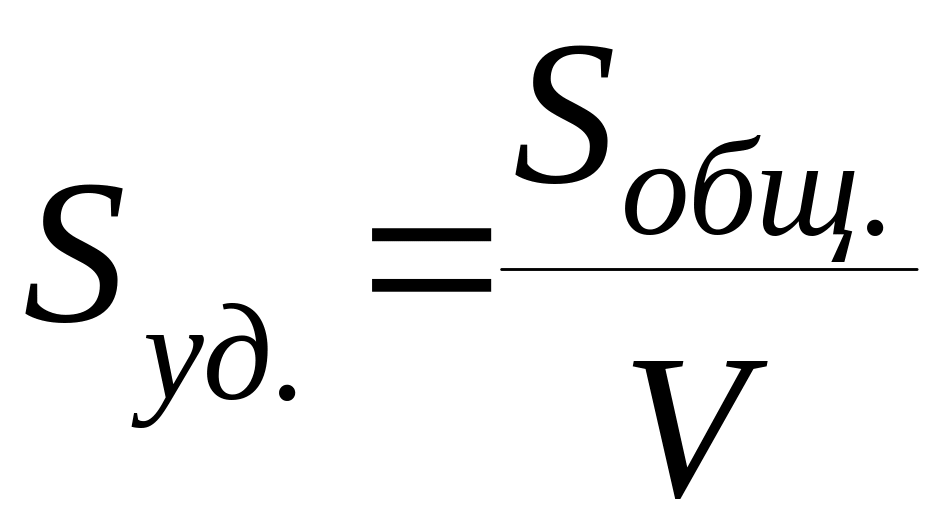 м2/кг
или м2/м3
м2/кг
или м2/м3
Наиболее распространенными методами определения удельной поверхности являются адсорбционные методы. Используя их, величину поверхности, приходящуюся на единицу массы материала, вычисляют по количеству поглощенных этой поверхностью веществ из раствора или газовой фазы. Правильный расчет удельной поверхности возможен, если известно строение адсорбционных слоев.
Известны два типа адсорбции: мономолекулярная и полимолекулярная. В первом случае поглощаемое вещество распределяется по поверхности адсорбента, образуя слой, толщина которого не превышает размеров одной молекулы. Адсорбция по второму типу приводит к образованию на поверхности раздела нескольких слоев адсорбированного вещества.
Расчет удельной поверхности по данным мономолекулярной адсорбции достаточно прост. При этом используется формула
![]()
где:
![]() - максимально возможное число моль
вещества, поглощенное 1 г адсорбента;
- максимально возможное число моль
вещества, поглощенное 1 г адсорбента;
Nа - число Авогадро;
S0 - площадь, занимаемая одной молекулой адсорбированного вещества при максимальной упаковке молекул в адсорбционном слое.
Обычно величина S0 приводится в справочниках.
Для нахождения
величины m![]() используют уравнение изотермы
мономолекулярной адсорбции, предложенное
И.Ленгмюром:
используют уравнение изотермы
мономолекулярной адсорбции, предложенное
И.Ленгмюром:
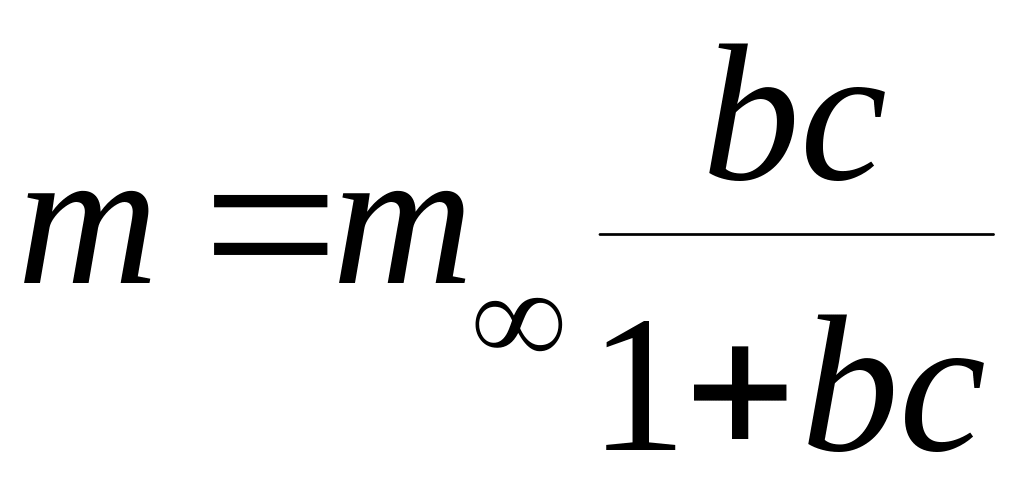
где: m - количество адсорбированного вещества при данной концентрации С;
b - постоянная.
Задача эксперимента сводится к определению конкретного вида зависимости адсорбции от концентрации. Если эта зависимость установлена, то константы уравнения находят, представляя изотерму в координатах (1/m , 1/С).Как видно из рисунка 2 в этих координатах изотерма представляет собой прямую, уравнение которой:
![]()


 m
1/m
m
1/m
![]()
1/m∞
C 1/C
Рис.1 Изотерма Ленгмюра Рис.2 Спрямленная изотерма
Ленгмюра.
Для вычисления адсорбции необходимо измерить концентрацию до адсорбции С1 и после достижения адсорбционного равновесия С2.
Расчет производят по формуле:
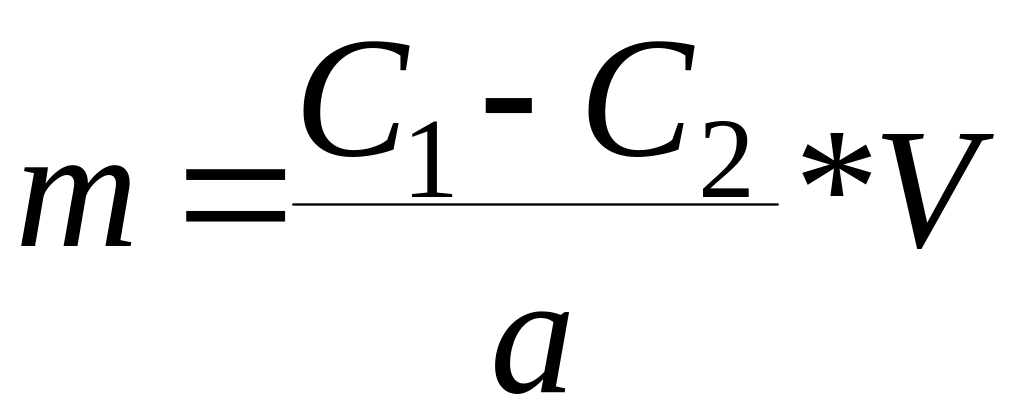
где: V - обьем раствора;
а - навеска адсорбента.
Способ определения концентраций С1 и С2 зависит от свойств адсорбируемого вещества. Например, если адсорбируются карбоновые кислоты, то наиболее просто установить их концентрацию титрованием щелочью. В случае применения радиоактивных веществ, концентрация последних устанавливается измерением радиоактивности.
Если в качестве адсорбируемого соединения используется низкомолекулярные ПАВ - спирты или карбоновые кислоты, в водных растворах которых адсорбционное равновесие устанавливается достаточно быстро, можно использовать для определения концентрации ПАВ измерение поверхностного натяжения.
Зависимость поверхностного натяжения от концентрации для большинства ПАВ описывается уравнением Б. Шишковского:
![]()
где:
![]() -
поверхностное натяжение раствора ПАВ
концентрации С;
-
поверхностное натяжение раствора ПАВ
концентрации С;
![]() -
поверхностное натяжение чистой воды;
-
поверхностное натяжение чистой воды;
а, b - постоянные уравнения.
Зависимость адсорбции от поверхностного натяжения и концентрации дается уравнением Гиббса:
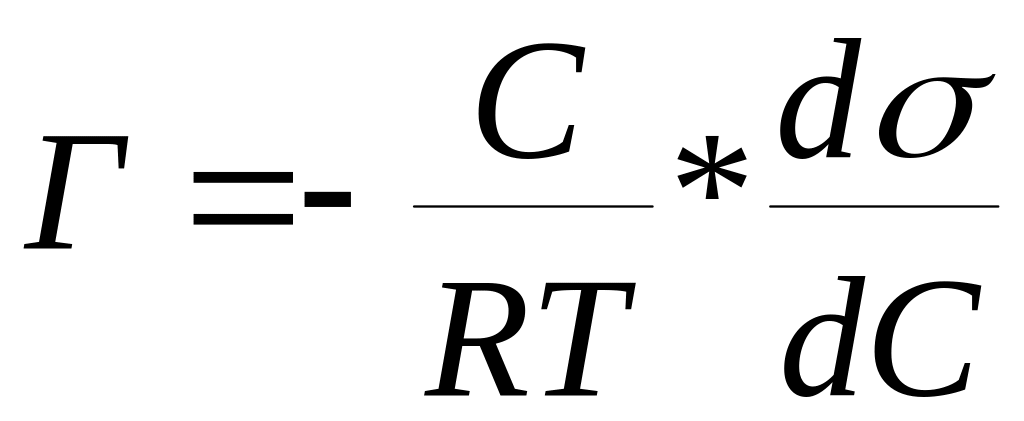
В данной работе удельную поверхность определяют по адсорбции уксусной кислоты активированным углем.
