
- •Министерство образования и науки Российской Федерации гоу впо “Уральский государственный лесотехнический университет”
- •261201, 280201, 280202 Инженерно – экологического; 020802, 120302, 250100, 250201, 250203 лесохозяйственного и 150400, 190500, 190603, 190701,190702 лесомеханического факультетов)
- •Оглавление
- •Раздел 1. Оптические методы анализа
- •Раздел 2. Электрохимия
- •Введение
- •Раздел 1. Оптические методы анализа Введение
- •Природа и свойства электромагнитного излучения
- •Процесс поглощения
- •Закон Бугера-Ламберта-Бера
- •Применение оптических методов для анализа дисперсных систем (методы нефелометрии и турбидиметрии)
- •Фотоэлектрическое титрование
- •Фотоколориметры и спектрофотометры
- •Метод добавок
- •Примеры научно-исследовательских работ по оптическим методам анализа
- •Вопросы для самопроверки
- •Решение типовых задач
- •Раздел 2. Электрохимия
- •2.1. Потенциометрический анализ
- •Потенциометрические измерения
- •Примеры научно-исследовательских работ
- •Вопросы для самопроверки
- •Решение типовых задач
- •2.2. Кулонометрический анализ
- •Теоретические основы. Сущность и классификация методов
- •Лабораторные работы
- •Вопросы для самоконтроля
- •Решение типовых задач
- •2.3. Полярографический анализ
- •1. Теоретические основы
- •1 Источник напряжения
- •2Регулятор напряжения (реостат);
- •3Ячейка;
- •2. Особенности полярографического метода
- •3. Методы анализа и расшифровки полярограмм
- •4. Амперометрическое титрование
- •Лабораторные работы
- •Вопросы для самоконтроля
- •Решение типовых задач
- •Раздел 5. Кондуктометрические методы анализа
- •5.1. Кондуктометрические методы анализа
- •5.2. Теоретические основы кондуктометрического метода анализа. Основные законы и формулы
- •5.3. Зависимость электропроводности от экспериментальных параметров
- •5.4. Применение прямой кондуктометрии
- •5.5. Кондуктометрические методы в физико-химических исследованиях
- •5.6. Кондуктометрическое титрование
- •5.7. Высокочастотное кондуктометрическое титрование
- •5.8. Особенности кондуктометрических методов анализа
- •1.Титрование сильной кислоты сильным основанием
- •2. Титрование слабой кислоты сильным основанием.
- •5. Титрование соли солью с образованием осадка
- •Лабораторные работы
Лабораторные работы
Работа 2. Амперометрическое определение цинка
Гексацианоферроат (II) калия (ферроцианид калия К4[Fe (CN)6]) образует с цинком, кадмием и рядом других металлов труднорастворимые соединения, например:
3Zn 2+ + 2K4[Fe(CN)6] → K2Zn3[Fe(CN)6]2↓ + 6K+
5Cd2+ + 4K4[Fe(CN)6] → K6Cd5[Fe(CN)6]4↓ + 10K+
При взаимодействии с цинком возможно протекание реакции образования простой соли Zn[Fe(CN)6]2, также выпадающий в осадок.
Амперометрическое титрование проводят по уменьшению силы тока катодного восстановления определяемого металла до нулевого значения в точке эквивалентности по реакции:
Me+4 + 4e- → Me0
или по увеличению силы тока анодного окисления избытка титранта К4[Fe (CN)6] после достижения толчки эквивалентности:
[Fe (CN)6]4- - е- → [Fe (CN)6]5-
Применение платиновых электродов при определении цинка с использованием последней реакции позволяет достичь более высокой точности и селективности анализа.
Методика проведения анализа
Этап 1. Выбор потенциала электрохимического окисления стандарта К4[Fe (CN)6].
Очищают поверхность платинового анода (микроэлектрод) погружением в раствор азотной кислоты HNO3 (1:1), затем трижды обмывают рабочую поверхность электрода дистиллированной водой. В электролизер заливают цилиндром 1мл 0,1 М раствора титранта, добавляют 30 мл 0,5 М раствора сульфата калия K2SO4 (фон). В ячейку опускают электроды, доливают дистиллированной воды до полного погружения их рабочих поверхностей в раствор и перемешивают его на магнитной мешалке 1-2 минуты. Включают прибор и постепенно изменяют потенциал в интервале 0 ÷1,5 В через каждые 0,2 В регистрируют показания миллиамперметра.
По полученным данным строят вольтамперную зависимость I=f(E) и выбирают значение потенциала, соответствующее предельному току окисления ферроцианида К4[Fe(CN)6]. Ячейку и электроды ополаскивают дистиллированной водой.
Этап 2. Анализ исследуемого раствора хлорида цинка ZnCl2
Анализируемый раствор в мерной колбе на 100,00 мл доводят до метки дистиллированной водой и перемешивают. Аликвотную часть полученного раствора (10,00 мл) пипеткой переносят в электролизер, добавляют цилиндром 25 мл фонового раствора K2SO4 и 2-3 мл 2% аммиака при перемешивании на магнитной мешалке до растворения образовавшейся мути. Включают прибор и при выбранном на этапе 1 потенциале рабочего электрода (750-950 мВ) титруют из бюретки 0,1000 М стандартным раствором К4[Fe(CN)6].по 0,20 мл до возрастания тока, регистрируя показания миллиамперметра. Добавляют проверочные 3-4 порции стандарта, фиксируют значения увеличивающейся токовой величины. Аналогично проводят повторное (параллельное) титрование.
Обработка экспериментальных данных
По результатам титрования строят кривые в координатах I=f(Vст.р-ра).По излому на этих зависимостях определяют объемы стандартного раствора К4[Fe(CN)6], соответствующие точке эквивалентности и рассчитывают содержание цинка в анализируемом растворе, считая что аналитическая реакция идет по уравнению:
3ZnCl + 2K4[Fe(CN)6] → K2Zn3[Fe(CN)6]2↓ + 6KCl
В этом случае используется формула расчета количества цинка:
![]()
где М- молярная концентрация ферроцианида калия;
А – атомная масса цинка (65);
Vэ.т. – объем стандарта, пошедшего на титрование, мл;
Val – объем аликвоты.
Находят среднее значение Сср, г/л.
Работа 3. Биамперометрическое определение меди (титрование по замещению)
Титрование проводят с использованием двух индикаторных электродов. Определение основано на восстановлении в растворе двухвалентной меди йодидом калия и восстановлении образовавшегося молекулярного йода на платиновом электроде. Последующее титрование обратимой окислительно-восстановительной системы (I2/2I-) стандартным раствором тиосульфатом натрия (система S4O62-/2S2O32- необратима) обуславливает сложный характер изменения токовых значений (возрастание, прохождение через максимум и снижение до минимальной величины в точке эквивалентности).
Схема используемой для анализа установки аналогична представленной в работе 2 (рис. 5).
В анализируемом растворе протекает реакция замещения:
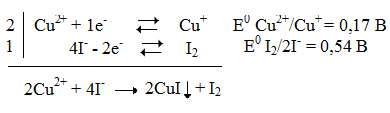
При введении избыточного количества йодид-ионов реальный потенциал пары окислителя (меди) возрастает до 0,70 В за счет снижения концентрации одновалентной меди связываемой в осадок CuI↓ согласно уравнению В. Нернста:
![]()
В ходе титрования идут процессы:
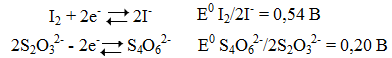
Методика проведения анализа
Анализируемый раствор двухвалентной меди доводят до метки в мерной колбе на 100,00 мл и перемешивают. В ячейку для титрования пипеткой вносят 20,00 мл приготовленного раствора, добавляют в качестве фона 20 мл 2 н Н2SO4 (мерным цилиндром) и, на кончике шпателя ~ 1,0 г йодида калия. Разбавляют исследуемую систему дистиллированной водой до середины высоты ячейки, помещают её на магнитную мешалку и перемешивают содержимое в течении 3 мин для завершения реакции замещения.
Погружают в раствор платиновые электроды и задают напряжение 20,0 мВ. Титруют исследуемую систему 0,1000 н тиосульфатом натрия по 0,10 мл, регистрируя показания тока после каждой порции стандарта. При достижении минимального значения тока (I, мВ) добавляют 3-4 проверочные порции титранта. Аналогично проводят повторное (параллельное) титрование.
Обработка экспериментальных данных
По результатам титрования строят кривые в координатах I=f(VNa2S2O3) (интегральная зависимость). Определяют среднее значение объема тиосульфата натрия (V), соответствующее точке эквивалентности и рассчитывают содержание меди в пробе:
![]()
где
![]() ;
Val=20,00
мл.
;
Val=20,00
мл.
Работа 4. Вольтамперометрическое определение тирозина
Схема определения. Тирозин является одной из немногих аминокислот, электроактивных при потенциалах, значительно превышающих окисление ртути. Поэтому его определение проводят на твердом (графит) электроде, а в качестве электрода сравнения применяют хлорсеребряный полуэлемент. Для создания ионной силы раствора, обеспечивающей достаточную электропроводность используют серную кислоту.
Электрод Электрод
индикаторный неполяризуемый
(графит) (хлорсеребряный)
 Ø
Ø
Ø
Ø
С 9Н11NO3
+ H2SO4
9Н11NO3
+ H2SO4
Фон
Окисление тирозина на графите происходит по уравнению
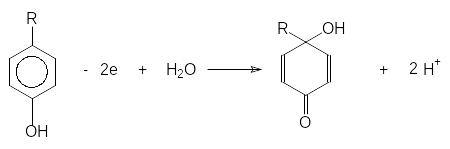
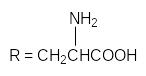
где
Методика проведения анализа. В пять мерных колб на 100,00 мл отбирают 0,00; 1,00; 2,00; 3,00; 4,00 мл исследуемого раствора тирозина и доводят (из бюретки) до меток 0,02 н серной кислотой. Растворы последовательно заливают в ячейку с электродами, помещают ее на магнитную мешалку и при интенсивном перемешивании снимают вольтамперные зависимости от 0,5 В до потенциала разряда чистого фона (Н2SO4). Перед снятием каждой вольтамперограммы зачищают до блеска рабочую поверхность графитового электрода (торец) фильтровальной бумагой и промывают оба электрода дистиллированной водой.
Обработка экспериментальных данных. После построения графиков зависимостей Ji =fEi измеряют высоты полярографических волн (предельных токов Jпр) и потенциалы полуволн (Е1/2). Определяют наличие необратимости окисления тирозина в данных условиях по влиянию разбавления на значение Е1/2. В случае непостоянства величин потенциалов полуволн или размытости полярографических волн снимают две дополнительные полярограммы с наибольшим содержанием тирозина при концентрации фона (Н2SO4) 0,04 и 0,06 н.
Концентрацию тирозина определяют по уравнению
С, моль/л
=![]() ,
,
где К эмпирический коэффициент, определенный при анализе стандартных растворов тирозина;
Vал объем аликвот исследуемого раствора;
100 объемы мерных колб, используемых при приготовлении анализируемых растворов.
