
- •Министерство образования и науки Российской Федерации гоу впо “Уральский государственный лесотехнический университет”
- •261201, 280201, 280202 Инженерно – экологического; 020802, 120302, 250100, 250201, 250203 лесохозяйственного и 150400, 190500, 190603, 190701,190702 лесомеханического факультетов)
- •Оглавление
- •Раздел 1. Оптические методы анализа
- •Раздел 2. Электрохимия
- •Введение
- •Раздел 1. Оптические методы анализа Введение
- •Природа и свойства электромагнитного излучения
- •Процесс поглощения
- •Закон Бугера-Ламберта-Бера
- •Применение оптических методов для анализа дисперсных систем (методы нефелометрии и турбидиметрии)
- •Фотоэлектрическое титрование
- •Фотоколориметры и спектрофотометры
- •Метод добавок
- •Примеры научно-исследовательских работ по оптическим методам анализа
- •Вопросы для самопроверки
- •Решение типовых задач
- •Раздел 2. Электрохимия
- •2.1. Потенциометрический анализ
- •Потенциометрические измерения
- •Примеры научно-исследовательских работ
- •Вопросы для самопроверки
- •Решение типовых задач
- •2.2. Кулонометрический анализ
- •Теоретические основы. Сущность и классификация методов
- •Лабораторные работы
- •Вопросы для самоконтроля
- •Решение типовых задач
- •2.3. Полярографический анализ
- •1. Теоретические основы
- •1 Источник напряжения
- •2Регулятор напряжения (реостат);
- •3Ячейка;
- •2. Особенности полярографического метода
- •3. Методы анализа и расшифровки полярограмм
- •4. Амперометрическое титрование
- •Лабораторные работы
- •Вопросы для самоконтроля
- •Решение типовых задач
- •Раздел 5. Кондуктометрические методы анализа
- •5.1. Кондуктометрические методы анализа
- •5.2. Теоретические основы кондуктометрического метода анализа. Основные законы и формулы
- •5.3. Зависимость электропроводности от экспериментальных параметров
- •5.4. Применение прямой кондуктометрии
- •5.5. Кондуктометрические методы в физико-химических исследованиях
- •5.6. Кондуктометрическое титрование
- •5.7. Высокочастотное кондуктометрическое титрование
- •5.8. Особенности кондуктометрических методов анализа
- •1.Титрование сильной кислоты сильным основанием
- •2. Титрование слабой кислоты сильным основанием.
- •5. Титрование соли солью с образованием осадка
- •Лабораторные работы
Потенциометрические измерения
На завершающей стадии анализа часто используют прямое потенциометрическое измерение. Методика таких измерений проста и состоит в том, что сравнивается потенциал индикаторного электрода в растворе определяемого вещества с потенциалом этого же электрода, погруженного в стандартный раствор того же вещества. Измерив потенциал электрода для растворов известной концентрации или активности, можно построить калибровочный график, по которому затем можно найти концентрацию (активность) раствора того же вещества, измерив в тех же условиях потенциал раствора. Метод калибровки сочетает такие достоинства, как простота, экспрессность, пригодность для длительного определения.
Потенциометрическое титрование
С помощью подходящего индикаторного электрода удобно устанавливать точку эквивалентности. Этот метод особенно удобен при определении мутных и окрашенных растворов. Потенциометрический метод может быть использован для всех видов титрования: кислотно-основного, окислительно-восстановительного, комплексонометрического, осадительного.
При определении вещества потенциометрическим методом необходимо иметь в виду следующее:
чувствительность метода определяется правильным выбором индикаторного электрода;
величина скачка вблизи точки тем больше, чем выше концентрации стандартного и исследуемого растворов;
величина скачка также зависит от константы ионизации слабой кислоты или слабого основания и тем больше, чем больше соответствующая константа;
в случае титрования смесей двух или более веществ сначала оттитровывается вещество, имеющее более высокую степень ионизации, окислительно-восстановительный потенциал, величину ПР или устойчивость образующегося комплексного соединения;
в начале титрования титрант можно приливать большими порциями, а в близи эквивалентной точки (на это укажут большие изменения показаний прибора) стандартный раствор следует приливать одинаковыми порциями не более 0,2 мл.
Для определения конечной точки титрования можно использовать различные способы. Наиболее простой в построении графика зависимости рХ от объема приливаемого титранта (рис. 1а). Конечную точку титрования определяют как среднюю точку участка, соответствующего вертикального подъема кривой. Однако этот способ не всегда позволяет зафиксировать конечную точку титрования, особенно в случае титрования смесей веществ либо веществ, отличающихся малыми значениями соответствующего физико-химического параметра (константа нестойкости, окислительно-восстановительный потенциал и т.д.).
Другие способы расчета конечной точки состоят в определении изменения потенциала на единицу изменения объема ΔрХ/ΔV от объема титранта (рис. 1б) либо в определении точки, в которой вторая производная Δ2pX/ΔV2 от объема титранта равна нулю (рис. 1в).
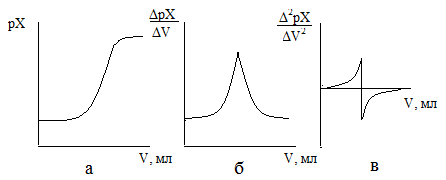
Рисунок 1. – Обработка кривых титрования
Иономеры и рН-метры. Для определения разности потенциалов используют высокоомные вольтметры заводского изготовления, шкала которых откалибрована в единицах рН и милливольтах. В число таких приборов входят ЭВ-74, рН-340, рН-510 «Эксперт – 001» и др.
В качестве электродов сравнения чаще используют хлорсеребряный электрод, в качестве индикаторных – стеклянный (для контроля рН среды), платиновый (для контроля окислительно-восстановительного потенциала), ионоселективные – серебряный (для контроля галогенидов), калиевый, кальциевый, фторидный и др.
