
НЕФТЕПЕРЕРАБОТКА
.pdf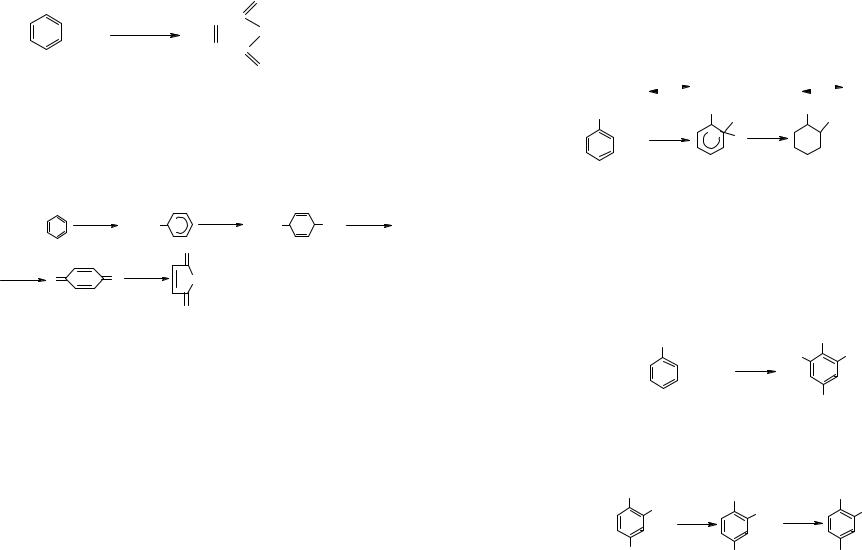
vk.com/club152685050 | vk.com/id446425943
|
|
|
HC - C |
O |
|
|
V2O5, MoO3 |
|
O + 4 CO + 4H O |
||
+ 9O |
2 |
|
|||
|
|
||||
2 |
|
|
HC - C |
2 |
2 |
|
|
|
O |
|
|
|
|
|
|
|
|
При окислении на переходных металлах вначале кислород адсорбируется на поверхности металла с образова-
нием ион-радикала.
Ме+n + O2  Men+1– O–O .
Men+1– O–O .
При взаимодействии образовавшегося ион-радикала с бензолом образуется промежуточное соединение, превращающееся далее в конечный продукт.
+ . |
Me+OO |
O2 |
Me+OO |
OO |
. |
|
|||||
Me OO + |
|
O |
|
-Me+OO. |
|
|
|
|
|
|
|
O |
2O2 |
O |
|
|
|
O |
|
|
|
||
|
-CO2,H2O |
|
|
|
|
O
Малеиновый ангидрид (около 60 %) применяется для получения ненасыщенных полиэфиров и алкидных смол, которые образуются при его взаимодействии с гликолями. Из полиэфирных смол изготавливают стеклоармированные детали для корпусов автомобилей, лодок, труб и др. Алкидные смолы в основном идут на материалы для покрытий (краски, лак, глазурь, эмаль).
Малеиновый ангидрид широко используется для производства пластификаторов и двухосновных кислот (фумаровой, малеиновой, янтарной). Около 15 % от общего количества малеинового ангидрида используется на производство присадок, улучшающих индекс вязкости и диспергирующих присадок для смазочных масел.
9.4.2. Синтезы на основе толуола
Толуол в промышленном масштабе подвергают нитрованию с целью получения нитропроизводных и далее диизоцианатов.
Нитрование осуществляется смесью азотной и серной кислот. В нитрующей смеси происходит кислотно-основ- ное взаимодействие, которое ведёт к образованию активного нитрующего агента – иона нитрония N+O2
|
|
|
|
|
|
|
|
+ |
|
|
|
+ |
|
|
|
||
HNO + H |
SO |
4 |
|
|
|
H O-NO + HOSO O- |
|
|
|
|
NO + HSO |
- + H O |
|||||
|
|
|
|
|
|
||||||||||||
3 |
2 |
|
2 |
2 |
2 |
|
|
|
|
|
2 |
4 |
2 |
||||
CH3 |
|
+ |
|
|
|
CH3 NO |
2 |
CH3 |
NO2 |
+ |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
+NO2 |
+ |
H |
|
|
|
|
+ H |
|
|
|||||||
Ввиду значительного дезактивирующего влияния нитрогруппы каждая последующая стадия нитрования протекает значительно медленнее предыдущей; поэтому реакцию можно осуществить с высоким выходом любого из продуктов последовательно-параллельного замещения (мо- но-, диили тринитропроизводных), подбирая соответствующие условия.
В промышленности получают тринитротолуол, который является взрывчатым веществом (тол, тротил):
CH |
3 |
O2N |
CH3 |
|
NO2 |
||
|
|
+ 3HNO3 
 -3 H2O
-3 H2O
NO2
На основе динитротолуола получают полиуретаны. Для этого 2,4-динитротолуол восстанавливают в 2,4-толуи- лендиамин, при конденсации которого с фосгеном образуется диизоцианат.
CH3 |
CH3 |
|
CH3 |
|
NO2 |
6H2 |
|
NH2 2COCl2 |
N=C=O |
|
-4 H2O |
|
-4 HCl |
|
NO2 |
NH |
2 |
|
N=C=O |
|
|
|
|
|
Более рациональным является процесс одностадийного получения диизоцианата в присутствии металлических катализаторов:
283 |
284 |

vk.com/club152685050 | vk.com/id446425943
CH3 |
|
|
|
|
CH |
3 |
||
NO2 |
|
|
|
|
|
|
|
|
190 |
0 |
C, 19,6 МПа |
|
|
|
N=C=O |
||
NO2 |
+ 6 CO |
|
|
|
|
|
|
+ 4 CO2 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
N=C=O |
||
|
|
|
|
|
||||
При взаимодействии диизоцианатов с диолами образуются полиуретаны
|
CH3 |
|
|
|
|
O |
|
||||
O=C=N |
N=C=O |
|
|
|
|
|
|
|
|
|
|
|
+ n HO-CH-CH -OH |
O=C=N |
|
|
|
NH-C-O-CH-CH2-O- H |
|||||
|
|
|
|
||||||||
|
|
|
|||||||||
|
2 |
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
CH3 |
n |
||
Конденсация толуилендиизоцианата с диолом даёт линейный полимер; если требуется образование поперечных связей, применяются полиолы. Таким полимером является пенополиуретан. Полиуретаны применяются как эластичные пенополимеры, но из них можно получать и твёрдые пенопласты и слоистые материалы (ламинаты).
Окисление толуола. Разработаны методы получения из толуола терефталевой кислоты — сырья для производства синтетического волокна лавсана, чтобы заменить дефицитный п-ксилол. На первой стадии толуол окисляют в бензойную кислоту:
1.5O2
C6H5CH3 -H2O  C6H5COOH
C6H5COOH
На следующей стадии получают калиевую соль бензойной кислоты:
+KOH
C6H5COOH -H2O C6H5COOK
C6H5COOK
На третьей стадии проводится диспропорционирование бензоата калия и затемпревращение в терефталевую кислоту:
2C6H5COOK  n-C6H4(COOK)2 + C6H6
n-C6H4(COOK)2 + C6H6
|
|
|
|
H2S |
COOH |
|
n- C |
H |
(COOK) |
|
n-C6H4 |
||
2 |
-K2S |
|||||
6 |
4 |
|
COOH |
|||
|
|
|
|
|
Основной стадией реакции является диспропорционирование бензоата калия с выделением СО2.
C6H5COO- 
 C6H5- + CO2
C6H5- + CO2
285
COO- |
COO- |
COO- |
CO2 |
C6H5 |
- |
|
+ |
+ |
H |
COO- |
COO- |
|
|
Процесс проводится в присутствии катализатора (5 %) нафтената или олеата кадмия или циркония при температуре 440-460 0С под давлением диоксида углерода 1-1,5 МПа.
Фирмой Mitsubishi Gas разработан метод получения терефталевой кислоты из толуола в присутствии катализатора BF3 HF при температуре 200-210 0С и давлении 2 МПа.
+CO(BF3 |
. HF) |
O2 |
C6H4(COOH)2 |
C6H5CH3 |
CH3C6H4CHO |
|
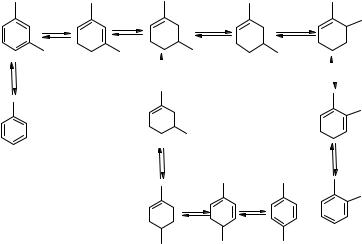
Алкилирование толуола. Делаются многочисленные попытки использовать толуол вместо дефицитного бензола. Так, при алкилировании толуола этиленом получается смесь трёх изомерных метилэтилбензолов.
AlCl3
CH3C6H5 + CH2=CH2  CH3C6H4CH2CH3
CH3C6H4CH2CH3
После отделения орто-изомера смесь п- и м-метилэтил- бензолов подвергают дегидрированию и получают смесь п- и м-винилтолуолов, которые можно использовать в качестве мономеров:
CH3C6H4CH2CH3 
 CH3C6H4CH=CH2
CH3C6H4CH=CH2
Важной областью применения толуола является его алкилирование метанолом для получения более дефицитных ксилолов, псевдокумола, дурола.
|
|
|
CH |
OH |
|
|
|
CH3OH |
|
|
|
CH OH |
|
||
C H |
CH |
3 |
|
|
C |
H (CH |
) |
|
C H (CH |
) |
|
3 |
C6H2(CH3)4 |
||
|
|
|
|
|
2 -H O |
|
|
||||||||
|
|
-H2O |
|
|
-H2O |
||||||||||
6 5 |
|
3 |
|
6 |
4 3 |
|
6 3 3 |
|
3 |
|
|||||
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Реакции протекают в паровой фазе над гетерогенными катализаторами кислотного типа с высоким выходом и являются вполне конкурентоспособными по сравнению с другими способами получения дефицитных или малодоступных метилбензолов.
Надо также отметить, что в настоящее время значительное количество толуола и ксилолов используется для компаундирования авиационного бензина, что связано с их
286
vk.com/club152685050 | vk.com/id446425943
хорошими октановыми характеристиками (октановое число 103-106), и в качестве растворителей.
9.4.3.Синтезы на основе ксилолов
Впродуктах нефтепереработки ксилолы содержатся в виде смеси о-, м-, п-изомеров и этилбензола.
Таблица 9.2 Содержание измеров ксилолов и этилбензола
в продуктах нефтепереработки
Продукты |
Каталити- |
Производ- |
Диспро- |
Темпера- |
Температу- |
|
ческийри- |
ствооле- |
порциони- |
туракипе |
разамер- |
|
форминг, % |
финов, % |
рование, % |
ния, 0С |
зания, 0С |
этилбензол |
26 |
52 |
- |
136,1 |
-94,4 |
пара-ксилол |
14 |
10 |
26 |
138,3 |
13,3 |
орто-ксилол |
41 |
25 |
50 |
144,4 |
-25,0 |
мета-ксилол |
19 |
19 |
24 |
139,1 |
-47,9 |
Температуры кипения изомеров ксилола очень близки, но они различаются по температурам замерзания. Ортоксилол отделяется от остальных компонентов перегонкой, так как температура его кипения сильно отличается от остальных. Температуры кипения этилбензола и пара-ксилола различаются всего на 2,2 0С, но они могут быть выделены при использовании многотарелочных ректификационных колонн. Однако разделение мета- и пара-ксилолов, температуры кипения которых различаются только на 0,8 0С, затруднено. Температуры замерзания этих углеводородов сильно различаются: мета-ксилол кристаллизуется при –47,9 0С, а параксилол — +13,3 0С, то есть температуры кристаллизации различаются более, чем на 60 0С. Поэтому их разделяют методом криогенной кристаллизации. Для разделения мета- и па- ра-ксилолов разработан также промышленный метод с использованием молекулярных сит.
Наибольшим промышленным спросом пользуется параксилол, а наименьшим — мета-ксилол. Поскольку содержание трёх изомеров в смесях ксилолов, полученных из разных
источников, сильно различается, разработаны процессы, в результате которых состав смеси ксилолов и этилбензола изменяется впользу пара-изомера засчётмета-изомера.
Запатентован целый ряд катализаторов изомеризации, таких как, алюмосиликатный катализатор с нанесённой платиной или хромом, трифторид бора в смеси со фтористоводороднойкислотой. Выходпара-ксилоласоставляетоколо70 %.
Таблица 9.3 Содержание трёх изомеров ксилолов и этилбензола, полученных в процессах нефтепереработки
Ароматические |
Содержание в сырье, % |
Содержание |
углеводороды |
|
визомеризате, |
Этилбензол |
26 |
- |
Пара-ксилол |
14 |
71 |
Мета-ксилол |
41 |
- |
Орто-ксилол |
19 |
20 |
Катализатор Pt/алюмосиликат является бифункциональным: атомы Pt выполняют функции дегидрирования, а на алюмосиликате имеются активные кислотные центры — доноры протонов. Механизм изомеризации мета-ксилола в параксилолследующий:
+H |
+H+ |
+ |
2 |
|
|
|
|
+ |
+
+H2


 -H2
-H2
+ CH4
+
-H2
+ -H+ |
-H2 |
Пара-ксилол является основным сырьём для производства терефталевой кислоты. Разработаны различные
287 |
288 |

vk.com/club152685050 | vk.com/id446425943
процессы окисления п-ксилола. Один из них основан на каталитическом окислении п-ксилола под давлением при 140-150 0С в присутствии солей кобальта или марганца. Реакция протекает по радикально-цепному механизму, образующуюся п-толуидиновую кислоту этерифицируют метиловым спиртом и доокисляют:
|
|
O2 |
|
|
|
|
|
CH OH |
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|||
CH3C6H4CH3 |
|
CH C H COOH |
3 |
CH C H COOCH |
2 |
||||||||
|
|
|
|||||||||||
|
|
|
3 |
6 |
4 |
|
-H2O |
3 |
6 |
4 |
3 |
|
|
O2 |
|
|
|
|
|
CH3OH |
|
|
|
|
|
||
HOOCC6H4COOCH3 |
|
H3COOCC6H4COOCH3 |
|
|
|||||||||
|
|
|
|
|
|
||||||||
Разработан одностадийный процесс окисления п- ксилола в терефталевую кислоту по схеме:
CH3C6H4CH3 HOOCC6H4CH3
HOOCC6H4CH3
 HOOCC6H4CHO
HOOCC6H4CHO  HOOCC6H4COOH
HOOCC6H4COOH
Процесс окисления n-ксилола проводят в среде монокарбоновых кислот в присутствии катализатора — соли переходного металла (Со и Мn) и промотора — бромсодержащей добавки. Применяется уксусная кислота при 195205 °С и давлении до 1,5 МПа. Количество вводимых промотора и катализатора — 0,45 % (масс). Выход терефталевой кислоты достигает 94-95 %, а её чистота 99 %.
Модификацией данного способа является окисление п- ксилола до терефталевой кислоты без применения агрессивных бромсодержащих добавок с использованием кобальтового катализатора и активатора — ацетальдегида, паральдегида (СбН12Оз), метилэтилкетона. Выход терефталевой кислоты достигает97-98 %.
При поликонденсации диметилового эфира терефталевой кислоты с этиленгликолем получают полиэфирный полимер – полиэтилентерефталат.
|
|
|
|
|
|
|
O |
O |
|
|
|
(n+1)HOCH2CH2OH + (n+1) CH3OC - |
-COCH3 |
||||||||||
|
|
O |
O |
|
O |
||||||
|
|
- |
|
|
|
COCH2CH2O- |
|
|
|
||
|
|
|
|
||||||||
|
HOCH CH O- C - |
|
|
|
-C-O-CH -OH + (2n+1) CH3OH |
||||||
|
|
|
|
||||||||
2 |
2 |
|
|
|
|
|
|
2 |
|||
n
лавсан (дакрон, терилен).
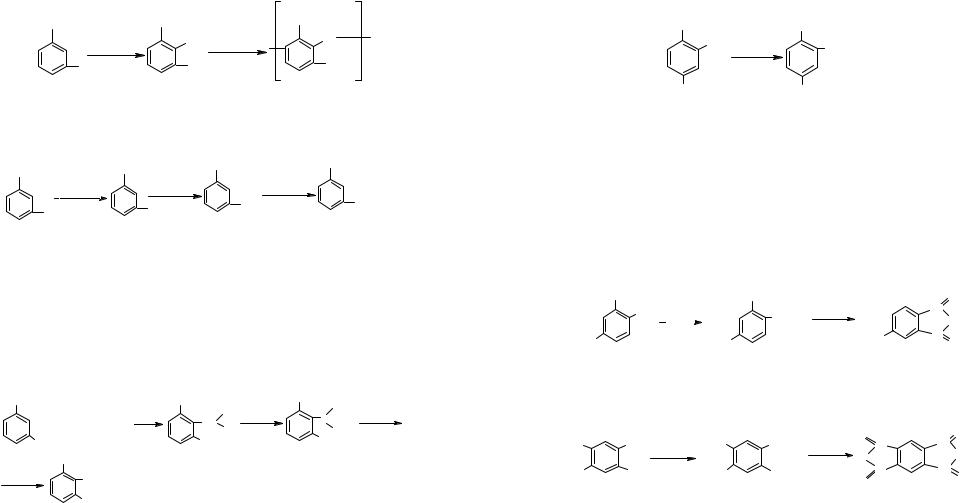
Орто-ксилол используется для получения фталевого ангидрида. Окисление орто-ксилола проводится кислородом воздуха в присутствии пятиокиси ванадия в качестве катализатора:
O2 |
C |
O |
|
O |
|||
CH3 |
C |
||
CH3 |
O |
||
|
|
Фталевый ангидрид получается и при аналогичном окислении нафталина.
Фталевый ангидрид применяется в производстве полиэфирных и алкидных смол, а также пластификаторов для поливинилхлорида.
C |
O |
COOR+ H O |
|
O+ ROH |
|||
C |
|
COOR |
2 |
O |
|
||
|
|
||
|
|
|
|
Этерификацией фталевого ангидрида получают промышленные пластификаторы поливинилхлорида — ди-(2- этилгексил)фталат и фталевый эфир смеси спиртов С7-С9 нормального строения. В качестве катализаторов применяются оксид титана TiO2 или его эфиры Ti(OR)4
При окислении м-ксилола при 160 0С и 1,5-2 МПа в присутствии ацетата марганца и бромида кобальта получают изофталевую кислоту
CH3 |
COOH |
|
O2 |
CH3 |
COOH |
Изофталевая кислота — мономер для получения теплостойкого полиимида, полиэфира и алкидных смол, а также пластификаторов для поливинилхлорида.
При окислении м-ксилола возможно также получение 2,6-ксиленола, а из него термостойкого полимера — поли- 2,6-диметил-1,4-дифениленоксида.
Из этого полиэфира прядут синтетическое волокно
289 |
290 |
vk.com/club152685050 | vk.com/id446425943
CH3 |
|
CH3 |
CH3 |
|
|
O2 |
OH |
O |
|
CH |
3 |
CH3 |
CH3 |
n |
|
|
|
Интерес представляет окислительный аммонолиз м- ксилола, в результате которого образуется изофталонитрил, при гидрировании которого получают м-ксилилендиамин и м-ксилилендиизоцианат
CH3 |
CN |
CH NH |
|
CH2NCO |
2 2 |
|
|
||
NH3+O2 |
|
H2 |
|
CH2NCO |
CH3 |
CN |
CH NH |
|
|
2 |
2 |
|
Окислительный аммонолиз проводится в паровой фазе при 400-550 0С.
Сополимеризацией адипиновой кислоты с м-ксилилен- диамином в Японии производят Найлон-658, м-ксилилендиа- мин используется также для производства м-ксилилендиизо- цианата иполиуретанов наего основе.
Алкилированием м-ксилола пропиленом получают 2,4- диметилизопропилбензол, из которого по аналогии с кумольным методом образуется 2,4-ксиленол
CH3 |
|
CH3 |
|
|
CH3 |
O2 |
CH3 CH |
|
|
|
|
|
|
COOH |
|||
|
|
|
|
|
|
|
|
3 |
CH |
+ CH2=CH-CH3 |
|
CH |
CH3 |
|
CH3. |
||
|
|
CH |
|
|
||||
3 |
|
3 |
|
|
CH3 |
|
||
|
|
|
|
|
|
|
||
CH3
OH+ CH3-CO-CH3 CH3
Ксиленол применяется в производстве пластмасс, ядохимикатов, фармацевтических препаратов.
Из фракции С4 катализата риформинга ректификацией выделяют псевдокумол (1,3,4-триметилбензол). Окислением его получают тримеллитовую кислоту и тримеллитовый ангидрид, которые применяются для производства пластификаторов, полиэфироимидных лакокрасочных покрытий, в качестве отвердителя эпоксидных смол.
CH3 |
COOH |
CH3 O2 |
COOH |
CH3 |
COOH |
9.4.4. Окисление три- и тетраметилбензолов
Более высокомолекулярные гомологи бензола в индивидуальном виде из нефти не выделяются, однако концентраты ароматических углеводородов, экстрагированные селективными растворителями из керосиновых фракций или дизельного топлива, находят применение. При окислении псевдокумола, мезиэтилена, геммеллитола получают бензолтрикарбоновые кислоты.
CH3 |
|
COOH |
|
C |
O |
CH |
4,5 O2 |
COOH |
|
O |
|
3 |
|
- H2O |
|
||
|
- 3H2O HOOC |
C O |
|||
H3C |
HOOC |
||||
псевдокумол |
|
тримеллитовая |
тримеллитовый |
||
|
|
кислота |
|
ангидрид |
|
При окислении 1,2,4,5-тетраметилбензола (дурола) образуется пиромеллитовая кислота и её диангидрид:
H3C |
CH3 |
+6 O2 HOOC |
COOH |
|
O |
|
O |
|
-2 H2O |
O C |
C O |
||||||
H3C |
CH3 |
- 4H2O HOOC |
COOH |
O |
C |
C O |
||
|
||||||||
Эти кислоты используют в качестве сырья для получения пластификаторов, термостойких полимеров, присадок, эпоксидных смол, красителей.
9.4.5. Применениенафталинаиполициклических углеводородов
Нафталин и полициклические ароматические углеводороды содержатся в жидких продуктах пиролиза, получаемых на этиленовых установках, при использовании в
291 |
292 |
vk.com/club152685050 | vk.com/id446425943
качестве сырья низкооктановых бензинов и газойля. Их выделяют также из каменноугольной смолы, которая образуется при коксовании каменного угля с целью получения металлургического кокса.
На установке ЭП-300 при пиролизе низкооктанового бензина получается 6-6,5 тыс.т/год нафталина и его алкилпроизводных, а при пиролизе газойля — 18-24 тыс.т/год. Получающийся нафталин, в отличие от коксохимического, почти не содержит бензотиофена, а примеси алкенов легко удаляются гидрированием. Нафталин в промышленности получается также гидроалкилированием алкилнафталинов, содержащихся в тяжёлых фракциях пиролизной смолы и катализатов риформинга.
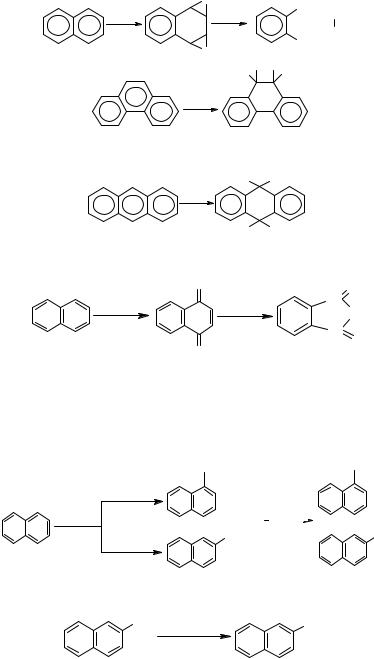
Нафталин и полициклические углеводороды — фенантрен, антрацен, хризен, пирен — как и бензол, подчиняются правилу Хюккеля — содержат 4n+2 π-электронов на связывающих молекулярных орбиталях. Молекулы этих углеводородов плоские, для них характерны высокие значения энергий сопряжения и комплекс свойств аренов. В частности, все эти углеводороды, как и бензол, легко вступают в реакции электрофильного замещения.
Все конденсированные арены в большей или меньшей степени приближаются к непредельным соединениям. Так, нафталин значительно менее устойчив и более реакционноспособен, чем бензол. В отличие от молекулы бензола, в которой все углерод-углеродные связи равноценны, в молекулах нафталина и полициклических аренов связи неравноценны.
В молекуле нафталина связи 1-2, 3-4, 5-6 и 7-8 имеют более высокий порядок, более непредельны и имеют меньшую длину, чем связи 2-3 и 6-7. В молекуле фенантрена наибольшая электронная плотность характерна для связи 9-10, приближающейся по характеру к двойной. Естественно, что реакции присоединения идут по связям с более высоким порядком и с большей скоростью, чем в случае бензола:
O2 |
O3 |
CHO |
CHO |
H2O |
|||
|
|
+ |
CHO |
|
|
CHO |
|
|
O3 |
|
|
|
|
|
|
|
X H |
X H |
|
|
X2 |
|
|
Реакции присоединения к молекулам антрацена идут за счёт мезо-положений 9 и 10:
H X
X2
H X
Нафталин в промышленности используют для производства фталевого ангидрида:
|
O |
C |
O |
O2 |
O2 |
O |
|
|
- 2CO2 |
C |
|
|
O |
||
|
O |
|
|
|
|
|
Окисление проводится при температуре 370-430 0С в присутствии катализатора — солей калия и ванадия, нанесённых на силикагель.
При сульфировании с последующим щелочным плавлением получаются нафтолы.
|
SO2OH |
|
OH |
+H2SO4 |
|
+NaOH |
|
-H2O |
SO2OH |
-Na2SO4 |
OH |
|
Нагреванием нафтолов с водяным раствором сульфита аммония получают нафтиламины.
OH (NH4)2SO4 |
NH2 |
293 |
294 |

vk.com/club152685050 | vk.com/id446425943
Нафтолы, сульфокислоты и нафтиламины используются для производства азокрасителей.
При гидрировании нафталина в присутствии никелевого катализатора получаются тетралин и декалин, которые являются ценными растворителями.
Промышленный интерес представляют некоторые алкилпроизводные нафталина. При алкилировании нафталина олефинами (от этилена до высших олефинов) в присутствии хлористого алюминия получаются полиалкилнафталины, которые применяются как синтетические смазочные масла.
Из монохлорпарафина и нафталина синтезируют диалкилнафталины, которые добавляются к смазочным маслам для понижения их температуры застывания (парафлоу).
C10H8 + C25H51Cl AlCl3 C10H6(C25H51)2 + 2HCl
C10H6(C25H51)2 + 2HCl
Взаимодействием нафталина с этилбензолом или этиленом в присуствии м-ксилола и хлорида алюминия получается 2-этилнафталин, который дегидрированием можно превратить в 2-винилнафталин. Полимеры винилнафталина и сополимеры его со стиролом имеют высокую механическую прочность и теплостойкость.
Окислением 2,6-диметилнафталина получают 2,6-наф- талиндикарбоновую кислоту — мономер для полиэфирных волокон более термо- и водостойких, чем полиэтилентерефталат.
295
vk.com/club152685050 | vk.com/id446425943
Глава 10
НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ, ОБРАЗУЮЩИЕСЯПРИПЕРЕРАБОТКЕНЕФТИ
10.1. Методыполучениянепредельных углеводородовизнефти
Непредельные соединения (алкены, ди-, три- и полиены, алкины) в сырой нефти и природных газах отсутствуют. Они образуются в процессах переработки нефти и являются важнейшим сырьём для нефтехимического синтеза.
Существует две группы процессов получения непредельных соединений из нефти: процессы, в которых они являются побочными продуктами, и специальные, направленные на их максимальную выработку. К первой группе относят термический и каталитический крекинг, риформинг и коксование нефтяных остатков, основное назначение которых — производство топлив и нефтяного кокса. Вторая группа включает пиролиз, полимеризацию низкомолекулярных алкенов, дегидрирование алканов и синтез высших алкенов в присутствии металлорганических катализаторов.
Объёмное содержание непредельных соединений в газах жидкофазного термического крекинга (470-520 °С; 2-5 МПа) составляет примерно 10 %, в газах пиролиза
(670-900 °С; 0,1 МПа) — 30-50 %. Среди алкенов терми-
ческих процессов преобладают этилен и пропилен; в меньшем количестве присутствуют бутены и бутадиен. Алкены, содержащиеся в газах каталитического крекинга, состоят в основном из пропилена и бутенов
(табл.10.1).
Таблица 10.1 Объёмный состав газов термической
и термокаталитической переработки нефтяного сырья, %
Компоненты |
Термиче- |
Коксование |
Пиролиз |
Каталитиче- |
|
ский кре- |
|
|
ский крекинг |
|
кинг |
|
|
|
|
|
|
|
|
1 |
2 |
3 |
4 |
5 |
Н2 |
0,4 |
1-2 |
10 |
1,0-1,5 |
Алканы |
16-20 |
20-30 |
40-45 |
8-12 |
СН4 |
19-20 |
15-20 |
6-10 |
8-10 |
С2Н6 |
25-28 |
5-10 |
1-2 |
10-15 |
С3Н8 |
5-7 |
3-5 |
1-2 |
20-25 |
изо-С4Н10 |
9-10 |
10-15 |
1-2 |
8-12 |
С4Н10 |
|
|
|
|
Алкены |
2-3 |
10-15 |
20-30 |
2-3 |
С2Н4 |
||||
С3Н6 |
9-10 |
20-25 |
12-15 |
10-15 |
С4Н8 |
9-10 |
10-15 |
1-2 |
15-20 |
C4H6 |
1-5 |
- |
3-10 |
- |
Высшие непредельные углеводороды содержатся также в жидких продуктах термической и каталитической переработки нефти. Так, массовое содержание непредельных соединений в бензине жидкофазного термического крекинга 30-35 %, бензине каталитического крекинга 10 %. Но они образуют такую сложную смесь углеводородов, что выделять их экономически невыгодно. Поэтому для получения высших олефинов в промышленности применяются следующие процессы:
1.Крекингтвёрдыхпарафинов;
2.ПроцессФишера-Тропша;
3.Кислотная полимеризация низкомолекулярных олефинов;
4.Полимеризация в присутствии катализаторов Циглера- Наттасобразованиемα-олефинов
296 |
297 |
vk.com/club152685050 | vk.com/id446425943 |
|
||||||
10.2. Физические свойства алкенов |
|
||||||
Низшие алкены (C1-C4) при обычных условиях — газы. |
|||||||
Алкены С5-C16 — жидкости, более высокомолекулярные алке- |
|||||||
ны — твёрдые вещества. Физические свойства алкенов при- |
|||||||
ведены в табл.10.2. |
|
|
|
|
|
||
|
Физические свойства алкенов |
Таблица 10.2 |
|||||
|
|
|
|||||
|
|
|
Темпе- |
Темпе- |
|
|
|
|
|
|
ратура |
ратура |
20 |
20 |
|
Название |
Формула |
плавле- |
кипения, |
nD |
ρ4 |
||
|
|
|
ния, 0С |
0С |
|
|
|
1 |
2 |
|
3 |
5 |
6 |
7 |
|
Этилен |
CH2=CH2 |
-169,2 |
-103,7 |
1,3630 |
0,5700 |
||
Пропилен |
СН3-СН=СН2 |
-185,2 |
-47,7 |
1,3623 |
0,5139 |
||
Бутен-1 |
CH3-CH2-CH=CH2 |
-185,3 |
-6,3 |
1,3777 |
0,5951 |
||
цис- |
H3C |
CH3 |
-138,9 |
+3,7 |
- |
0,6213 |
|
C=C |
|
||||||
H |
H |
||||||
Бутен-2 |
|
|
|
|
|||
H3C |
H |
|
|
|
|
||
транс- |
-105,5 |
+0,9 |
- |
0,6042 |
|||
C=C |
|
||||||
H |
CH3 |
||||||
|
|
|
|
|
|||
Изобутилен |
(СН3)2С=СН2 |
-140,3 |
-6,9 |
1,3796 |
0,5942 |
||
Пентен-1 |
СН3-(СН2)2- |
-165,2 |
+30,0 |
1,3715 |
0,6405 |
||
Пентен-2 |
СН=СН2 |
-151,4 |
36,9 |
1,3830 |
0,6556 |
||
2-Метилбутен-1 |
С2Н5(СН3)С=С |
-137,5 |
31,2 |
1,3778 |
0,6504 |
||
|
Н2 |
|
|
|
|
|
|
3-Метилбутен-1 |
(СН3)2СН- |
|
-168,5 |
20,1 |
1,3643 |
0,6272 |
|
|
СН=СН2 |
|
|
|
|
|
|
2-Метилбутен-2 |
(СН3)2С=СН- |
-133,8 |
38,6 |
1,3874 |
0,6623 |
||
|
СН3 |
|
|
|
|
|
|
Гексен-1 |
СН2=СН-(СН2)3- |
-139,8 |
63,5 |
1,3879 |
0,6732 |
||
СН3 |
|
||||||
|
|
|
|
|
|
||
2,3- |
CH3CH3 |
-74,3 |
73,2 |
1,4122 |
0,7080 |
||
|
|
||||||
Диметилбутен-2 |
CH3-C=C-CH3 |
||||||
|
|
|
|
||||
|
|
|
298 |
|
|
|
|
1 |
|
|
|
2 |
|
|
|
|
3 |
5 |
6 |
7 |
|
3,3- |
|
|
|
|
CH3 |
-115,2 |
41,2 |
1,3760 |
0,6529 |
||||
CH2=CH2-C-CH3 |
|||||||||||||
Диметилбутен-1 |
|||||||||||||
|
|
|
CH3 |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
||||||
Гептен-1 |
СН2=СН-(СН2)4- |
-119,0 |
93,6 |
1,3998 |
0,6970 |
||||||||
СН3 |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||||
Октен-1 |
СН2=СН-(СН2)5- |
-101,7 |
121,3 |
1,4087 |
0,7149 |
||||||||
СН3 |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||||
2,4,4-Триметил- |
|
|
CH3 |
|
|
|
CH3 |
-93,5 |
101,4 |
1,4086 |
0,7150 |
||
CH2=C |
-CH2- |
|
CH-CH3 |
||||||||||
пентен-1 |
|
||||||||||||
|
|
|
|
|
CH3 |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||||
2,4,4-Триметил- |
|
CH3 |
|
CH3 |
-106,3 |
104,9 |
1,4160 |
0,7218 |
|||||
CH3- |
C=CH- |
CH-CH3 |
|||||||||||
пентен-2 |
|||||||||||||
|
|
|
CH3 |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
||||||
Децен-1 |
СН2=СН-(СН2)7- |
-66,3 |
170,6 |
1,4215 |
0,7408 |
||||||||
СН3 |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||||
Октадецен-1 |
СН2=СН-(СН2)15- |
+17,6 |
314,8 |
1,4450 |
0,7888 |
||||||||
СН3 |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||||
Из данных по критической температуре видно, что этилен можно превратить в жидкость только при низкой температуре под высоким давлением, другие алкены сжижаются под давлением уже при охлаждении водой.
В промышленных процессах нефтепереработки алкены получаются в смеси с алканами. Их свойства заметно различаются, что используется при разделении смесей и выделении индивидуальных соединений. 1-Алкены нормального строения имеют более низкую температуру кипения и плавления, чем соответствующие алканы, но более высокую плотность и показатель преломления. Разветвлённые алкены имеют значительно более высокие температуры кипения и плавления, а также более высокую плотность, чем остальные изомеры. Цис-изомеры алкенов характеризуются более высокой температурой кипения, чем транс-изомеры.
299
vk.com/club152685050 | vk.com/id446425943
10.3. Применение алкенов в нефтехимическом синтезе
Химия алкенов определяется в основном наличием слабой и легко поляризуемой двойной связи -С=С-, которая взаимодействует как с электрофилами, так и со свободными радикалами. Характерными реакциями этих углеводородов являются реакции полимеризации, электрофильного присоединения, окисления и др.
10.3.1.Синтезы на основе этилена
Из всех алкенов по масштабам промышленного потребления первое место занимает этилен. Основной способ производства этилена — пиролиз углеводородного сырья. В настоящее время около половины заводов по производству этилена работают на этан-пропановом сырье, а остальные применяют низкооктановые бензины и газойль. Самый крупный потребитель этилена — производство полиэтилена. Для получения различных форм полиэтилена применяется 75 % от общего количества этилена, производимого во всём мире.
nCH2=CH2  -[-CH2-CH2]n-
-[-CH2-CH2]n-
Полиэтилен получают четырьмя способами: полимеризацией в массе (при высоком давлении), в растворе, в суспензии и в газовой фазе.
Полимеризация в массе осуществляется при высоком давлении (3500 атм) при температуре 200-340 0С в присутствии пероксидного инициатора. При этом получается разветвлённый полимер, имеющий низкую плотность —
0,920-0,935 г/см3 (ПЭНП).
Полимеризацию этилена в растворе проводят при значительно более низком давлении (84 атм) при температуре 200-315 0С на катализаторах Циглера-Натта. Эти катализаторы были открыты в 1950-60 годах Карлом Циглером и Джулио Натта. Они состоят из соединений титана (TiO2) и алюминийорганических производных (AlR3). Вместо тита-
на можно использовать производные других переходных металлов — циркония или ванадия. Преимущество этих катализаторов состоит в том, что они позволяют вести полимеризацию при низком давлении и низкой температуре. В 1980-е годы в промышленность были внедрены катализаторы на основе дихлорида бис(циклопентадиенил)циркония, которые сохраняют высокий уровень активности в течение длительного времени. Эти катализаторы позволяют получать линейный полиэтилен низкой плотности (ЛПЭНП). Последние открытия в области катализа связаны с появлением металлоценов в 1990-х годах. Такие катализаторы включают традиционные металлы: цирконий, титан, ванадий или палладий, которые входят в координационные соединения. В настоящее время эти катализаторы используются во всех четырёх вариантах полимеризации этилена. Они позволили создавать новые сочетания сомономеров, в частности, вводить в процесс стирол, акрилаты, оксид углерода, винилхлорид и норборнен. Металлоценовые катализаторы усиливают действие катализаторов Циг- лера-Натта при получении полиэтилена высокой плотности и линейного ПЭНП.
Полимеризацию в суспензии используют для получения полиэтилена высокой плотности. Этот процесс проводится в растворителе (н-гексан, изобутан или изопентан) при температуре 85-100 0С и давлении 5,25-10,5 атм. При этом образуется полиэтилен большой молекулярной массы, который характеризуется высокой плотностью и высокой температурой плавления (ПЭВП).
Процесс полимеризации в газовой фазе проводится при температуре 65-100 0С и давлении 21 атм в псевдосжиженном слое катализатора. При этом получаются ПЭВП и ЛПЭНП.
Наиболее важными характеристиками полимеров являются их такие свойства, как внешний вид, химические реакции, в которые они вступают, и поведение в различных условиях. Полиэтилен низкой плотности — более гибкий и
300 |
301 |
