
- •Тема 9. Электрохимические процессы Оглавление
- •Тема 9. Электрохимические процессы 1
- •Основные понятия и определения
- •История развития электрохимии
- •X Луиджи Гальвани, отец современной электрофизиологии и создатель теории «животного электричества» (1737 -1798) IX столетие
- •XX столетие
- •Структура темы
- •Окислительно-восстановительные реакции
- •Понятие окислителя и восстановителя
- •Степень окисления
- •Виды окислительно-восстановительных реакций
- •Электронные и электронно-ионные уравнения
- •Окислительно-восстановительный (red-ox) потенциал
- •Условие самопроизвольного протекания red-ox процессов
- •Контрольная работа 9.1.
- •Степень окисления - ……………….
- •Процессы в гальваническом элементе
- •Гетерогенные электрохимические процессы с участием металлов. Представление о металлической связи
- •Понятие об электродном потенциале, его образование в водных растворах элекролитов
- •Образование гальванического элемента. Электродвижущая сила (эдс)
- •Электроды сравнения 1-го рода. Стандартный водородный электрод
- •Электроды сравнения 2-го рода. Хлорид-серебрянный электрод
- •Определение электродных потенциалов металлов
- •Стандартные значения электродных потенциалов металлов. Ряд «напряжений»
- •Уравнение Нернста
- •Концентрационные гальванические элементы (кгэ)
- •Условие образования гальванического элемента
- •Поляризация в гальваническом элементе
- •8.1.3. Напряжение гальванического элемента
- •Контрольная работа 9.2.
- •Коррозия металлов
- •Коррозия в различных средах, влияние дополнительных факторов (воздействий)
- •Количественная оценка коррозии
- •Химическая коррозия
- •Электрохимическая коррозия
- •Коррозия с водородной деполяризацией
- •Коррозия с кислородной деполяризацией
- •Условие самопроизвольного протекания коррозии
- •Методы защиты от коррозии
- •Анодные и катодные покрытия
- •Протекторная защита
- •Электрозащита (катодная защита)
- •Пассиваторы, активаторы и ингибиторы коррозии
- •Электролиз
8.1.3. Напряжение гальванического элемента
Напряжение гальванического элемента - это предельное значение разности электродных потенциалов (напряжений) элемента ( ), при токе через элемент, стремящийся к нулю.
Оно равно разности равновесных потенциалов катода и анода элемента.
![]()
По уравнению, связывающему химическую
и электрическую энергии при известных
значениях энергии Гиббса реакции G,
рассчитывают величину
![]() :
:
![]() ,
,
где n - число электронов, участвующих в процессе;
F - постоянная Фарадея, равная 96500 Кл/моль;
- напряжение гальванического элемента.
При стандартных условиях, т.е. при концентрациях реагентов и продуктов реакции, равных 1 моль/л, температуре 298 К и давлении 1,01· 105 Па:
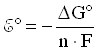 ,
,
где
![]() -
стандартное напряжение гальванического
элемента.
-
стандартное напряжение гальванического
элемента.
Откуда стандартная энергия Гиббса реакции элемента Даниэля-Якоби:
G(298 К) = -212,3 кДж/моль = -212,3 кВт· с/моль.
Стандартное напряжение элемента Даниэля-Якоби равно:
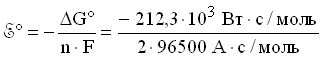
Контрольная работа 9.2.
Гальванический элемент ЭТО – ……..
Какой электрод является анодом? Какие процессы протекают на аноде?
Электродный потенциал - ………………. . Какие свойства металлов и как определяет ЭП?
Стандартный водородный электрод (СВЭ)- ….. Запишите равновесие, устанавливаемое на поверхности электрода. Приведите примеры ГЭ в которых СВЭ является анодом, катодом.
Запишите схему ГЭ составленного из Pb и Ni электродов (стандартные потенциалы примерно одинаковые) концентрация Pb2+ - 1 М/литр, Ni2+ - 0,001 М/литр.
ЭДС ГЭ это - …. Запишите условие образования ГЭ. Что происходит с ЭДС при работе ГЭ? Почему?
Коррозия металлов
Слово коррозия происходит от латинского corrodere, что означает разъедать. Хотя коррозию чаще всего связывают с металлами, но ей подвергаются также камни, пластмассы и другие полимерные материалы и дерево. Таким образом, коррозией называют самопроизвольный процесс разрушения материалов и изделий из них под химическим воздействием окружающей среды.
Коррозия металлов – окислительно-восстановительный процесс разрушения металлов вследствие химического или электрохимического взаимодействия их с внешней (коррозионной) средой.
В результате К. ежегодно теряется от 1 до 1,5% всего металла, накопленного и эксплуатируемого человечеством. В денежном выражении прямые потери от К. (на воспроизводство и замену вышедшего из строя оборудования) составили, по примерной оценке, в США за 1955 около 5,5 млрд. долларов, во Франции за 1959 около 250 млрд. франков. В СССР в конце 60-х гг. они были не ниже 5—6 млрд. рублей в год. Трудно учесть более высокие косвенные потери от простоев и снижения производительности оборудования, подвергшегося К., от нарушения нормального хода технологических процессов, от аварий, обусловленных снижением прочности металлических конструкций, и т. п. В народном хозяйстве всё шире применяются всевозможные средства и методы борьбы с К. (см. Антикоррозионная защита).
Коррозионные процессы классифицируют:
а) по виду (геометрическому характеру) коррозионных разрушений на поверхности или в объёме металла;
б) по механизму реакций взаимодействия металла со средой (химическая и электрохимическая К.);
в) по типу коррозионной среды;
г) по характеру дополнительных воздействий, которым подвергается металл одновременно с действием коррозионной среды.
Виды коррозионных разрушений. К., захватившая всю поверхность металла, называется сплошной. Её делят на равномерную и неравномерную в зависимости от того, одинакова ли глубина коррозионного разрушения на разных участках. При местной К. поражения локальны и оставляют практически незатронутой значительную (иногда подавляющую) часть поверхности. В зависимости от степени локализации различают коррозионные пятна, язвы и точки (питтинг). Точечные поражения могут дать начало подповерхностной коррозии. распространяющейся в стороны под очень тонким (например, наклёпанным) слоем металла, который затем вздувается пузырями или шелушится. Наиболее опасные виды местной К. — межкристаллитная (интеркристаллитная), которая, не разрушая зёрен металла, продвигается вглубь по их менее стойким границам, и транскристаллитная, рассекающая металл трещиной прямо через зёрна. Почти не оставляя видимых следов на поверхности, эти поражения могут приводить к полной потере прочности и разрушению детали или конструкции. Близка к ним по характеру ножевая коррозия, словно ножом разрезающая металл вдоль сварного шва при эксплуатации некоторых сплавов в особо агрессивных растворах. Иногда специально выделяют поверхностную нитевидную коррозию, развивающуюся, например, под неметаллическими покрытиями, и послойную К., идущую преимущественно в направлении пластической деформации. Специфична избирательная коррозия, при которой в сплаве могут избирательно растворяться даже отдельные компоненты твёрдых растворов (например, обесцинкование латуней).
