
- •Вводная часть
- •1. Основной закон светопоглощения (закон Бугера-Ламберта-Бера)
- •2. Спектры поглощения
- •3. Качественный и количественный анализ в абсорбционной спектроскопии
- •Задание для самостоятельного изучения курсантами и студентами 3 курса дисциплины «Физико-химические методы экспертного исследования»
- •Тема 13. Абсорбционная спектроскопия
- •I. Рассмотреть развернутый план темы.
- •III. Литература
2. Спектры поглощения
Свет поглощается раствором избирательно: при некоторых длинах волн светопоглощение происходит интенсивно, а при некоторых свет не поглощается. Интенсивно поглощаются кванты света, энергия которых h равна энергии возбуждения частицы и вероятность их поглощения больше нуля. Молярный коэффициент поглощения при этих частотах (или длинах волн) достигает больших значений.
Распределение по частотам (или по длинам волн) значений молярного коэффициента поглощения называется спектром поглощения.
Обычно спектр поглощения выражают в виде графической зависимости оптической плотности А или молярного коэффициента поглощения от частоты или длины волны падающего света. Вместо А или нередко откладывают их логарифмы.
Кривые в координатах lg А - , как показывает рис. 2, при изменении концентрации или толщины слоя перемещаются по ординате вверх или вниз параллельно самим себе, в то время как кривые в координатах А - (рис. 3) этим свойством не обладают.
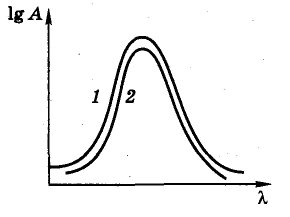
Рисунок 2. Зависимость lg А от : 1 – раствор концентрации с в кювете толщиной l (см); 2 – раствор концентрации 1/4с в кювете толщиной 1/4l (см).

Рисунок 3. Зависимость А от : 1 – раствор концентрации с в кювете толщиной l (см); 2 – раствор концентрации 1/4с в кювете толщиной 1/4l (см).
Эту особенность легко понять, если сравнить производные
 и
и
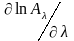
Действительно, при дифференцировании уравнения (2) получаем
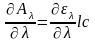
т. е. спектральная зависимость оптической плотности пропорциональна l и с.
При логарифмировании уравнения (2) и последующем дифференцировании имеем:

т. е. спектральная зависимость логарифма оптической плотности определяется только величиной ln и не зависит от l и с.
Существенное значение имеет эта особенность для качественного анализа.
Кроме
того, дифференциальная зависимость
 дает
возможность
более детально проанализировать спектр
и обнаружить максимумы,
скрытые при обычном представлении
спектра, как зависимости
А
=
f().
дает
возможность
более детально проанализировать спектр
и обнаружить максимумы,
скрытые при обычном представлении
спектра, как зависимости
А
=
f().
При изучении инфракрасных спектров на графике обычно откладывают процент светопропускания как функцию ' или .
Отдельные полосы в спектрах поглощения математически можно описать гауссовыми кривыми:

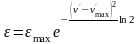
где и max — молярный коэффициент поглощения при данной длине волны (или волновом числе ') и при длине волны mах (или волновом числе `max), отвечающей точке максимума; ' и `max — данное волновое число и волновое число в точке максимума; характеризует ширину полосы, поглощения.
Действительно, при ' = `1/2 молярный коэффициент поглощения равен половине максимального 1/2 = ½ maxвместо уравнения имеем
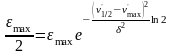
При упрощении и логарифмировании получаем

Откуда

Как видно, величина равна полуширине полосы на половине ее высоты.
Для несимметричных полос обычно указывают `max (max) и mах.
Таким образом, наибольший интерес представляют следующие характеристики спектра: число максимумов (или полос поглощения) и их положение по шкале длин волн (или частот); высота максимума; форма полос поглощения.
Происхождение спектров поглощения
Поглощение электромагнитного излучения возможно только у молекул, обладающих перманентным дипольным моментом.

Рис. Изменение молекулярного дипольного момента в результате вращения, колебания и электронного возбуждения
Согласно классической теории электрических диполей, периодическое изменение в пространстве их направления, размера либо того и другого приводит к эмиссии электромагнитного излучения. Если частота периодического изменения диполя есть v, то частота эмиссионного излучения тоже будет v. Периодическое движение диполя при этом постепенно затухает, его энергия преобразуется в излучение.
Возможен и обратный вариант, когда находящийся в состоянии покоя электрический диполь в результате поглощения электромагнитного излучения возбуждается до состояния периодических движений. Электромагнитное переменное поле света воздействует на центры тяжести положительного или отрицательного зарядов диполя и сообщает ему соответствующие периодические движения. Эти условия схематически показаны на примере двухатомной молекулы, обладающей непрерывным дипольным моментом (например, СО, НСl, NO и др.), см. риcунке.
Изменение дипольного момента по размеру и направлению осуществляется посредством вращения (случай «а»), колебания (случай «б») и изменения распределения электронов в молекуле (случай «в»).
Периодическое изменение молекулярного дипольного момента в результате вращения, колебания или электронного возбуждения достигается только с совершенно определенными частотами.
Следовательно, поглощение происходит, когда частота света совпадает с одной из возможных частот диполя. Этим объясняется избирательное поглощение из многочастотного непрерывного излучения.
Появление полос поглощения обусловлено дискретностью энергетических состояний поглощающих частиц и квантовой природой электромагнитного излучения. Интенсивно поглощаются кванты света, которые соответствуют энергии возбуждения частицы. При поглощении квантов света происходит увеличение внутренней энергии частицы, которая складывается из энергии вращения частицы как целого, энергии колебания атомов и движения электронов:
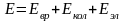
где Евр — вращательная; Екол — колебательная; Еэл — электронная энергия.
Это уравнение должно включать также слагаемые энергии тонкой и сверхтонкой структуры, связанные с электронным и ядерным спином, поправку на приближенность аддитивной схемы и некоторые другие слагаемые, которыми в первом приближении можно пренебречь.
По энергии вращательное, колебательное и электронное движение различаются весьма существенно, причем Eвр << Е кол << Е эл Их числовые значения относятся примерно как 1 : 102 : 103.
Каждый вид внутренней энергии молекулы, как уже отмечалось, имеет квантовый характер и может быть охарактеризован определенным набором энергетических уровней или термов и соответствующих квантовых чисел.
Кратко остановимся на вращательных, колебательных и электронных спектрах
Вращательные спектры
Вращательную энергию молекул обычно рассматривают с помощью модели жесткого ротатора (волчка), который представляет собой две массы, находящиеся одна от другой на фиксированном расстоянии.

Пусть двухатомная молекула состоит из атомов с массами m1 и m2, расстояние между которыми rо фиксировано. Расстояния соответствующих атомов от центра масс молекулы S обозначим как r1 и r2.
Момент инерции I такой молекулы равен
![]()
где символом обозначена так называемая приведенная масса.
Вращательные переходы, как и другие изменения внутренней энергии микрочастиц, квантуются. Возможные значения энергии вращательных состояний связаны с моментом инерции и вращательным квантовым числом J следующим образом:
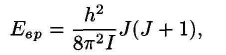
Для вращательных переходов существует правило отбора: J = ±1. С учетом этого правила приходим к выводу, что вращательный спектр состоит из набора линий, отстоящих друг от друга на равные промежутки 2В. Волновое число каждой такой линии равно
![]()
Схема переходов и вращательный спектр для модели жесткого волчка.
Однако экспериментальные спектры значительно отличаются от теоретических, рассчитанных для модели жесткого волчка. Основные отличия и их причины состоят в следующем.
• В экспериментальном спектре расстояния между соседними линиями закономерно уменьшаются с увеличением волнового числа. Это свидетельствует о несовершенстве модели жесткого волчка. С увеличением скорости вращения молекулы (т. е. с увеличением, J) увеличиваются и центробежные силы, вызывающие увеличение межатомного расстояния r.
• Экспериментально наблюдаемые интенсивности спектральных линий проходят через максимум. Это связано с различиями в заселенностях соответствующих уровней энергии и их различными статистическими весами.
• При исследовании молекул, состоящих из смеси изотопов (элементов с нецелочисленными атомными массами), например, 35Сl и 37Сl — наблюдается расщепление спектральных линий.
Для малых молекул таких, как НСl или NHз — энергии, необходимые для возбуждения вращательных переходов, находятся в ИК-области спектра. Для молекул большего размера, обладающих более высокими значениями момента инерции, эти энергии находятся в микроволновой области. Микроволновой спектрометр состоит из источника микроволнового излучения (клистрона), испускающего монохроматическое излучение в определенном диапазоне, камеры для пробы и кремниевого или германиевого детектора — приемника излучения. Исследуемые газообразные образцы должны находиться при пониженном давлении 0,1-10 Па для предотвращения межмолекулярных взаимодействий.
Возбуждение вращательных уровней энергии происходит уже при поглощении далекого инфракрасного (ИК) и микроволнового излучения, имеющего длину волны , > 102 мкм или волновое число ' < 102 см-1. Энергия квантов в этой области спектра равна: Евр = 2,8 • 10-3 ' = 1,2 кДж/моль и меньше. Это значение соизмеримо с энергией теплового движения kТ, поэтому уже при комнатной температуре часть вращательных уровней заселена.
В настоящее время чисто вращательные спектры в аналитических целях почти не используют. Их применяют главным образом для исследования строения молекул, определения межъядерных расстояний и т. д.
Колебательные спектры
Полосы, связанные с возбуждением колебательных уровней энергии, расположены в области спектра примерно от 200—300 до 4000—5000 см-1, что соответствует энергии квантов от 3 до 60 кДж/моль. Поэтому при обычных температурах энергетическое состояние молекул, как правило, характеризуется основным колебательным уровнем. Простейшей моделью, которая используется при рассмотрении колебаний двухатомной молекулы, является модель гармонического осциллятора. Это система из двух масс, связанных упругой силой.
Реальные колебания молекул ангармоничны и кривые потенциальной энергии молекул имеют более сложный характер (рис..4).
Энергию ангармонического осциллятора рассчитывают по формуле
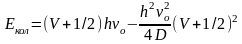
где D — энергия диссоциации молекулы.

Рисунок 4. Кривые потенциальной энергии и уровни энергии двухатомной молекулы
Энергетические уровни ангармонического осциллятора, как это следует из этого уравнения, с увеличением квантового числа сближаются. Для ангармонического осциллятора разрешенными являются переходы между любыми уровнями.
Наиболее интенсивной в спектре является первая полоса, возникающая при переходе V=0 на V=1. Этой полосе соответствует основная, или фундаментальная, частота. Менее интенсивные полосы дают обертоны, т. е. частоты, характеризующие переход с уровня V = 0 на уровень V = 2 (первый обертон или вторая гармоника); на уровень V = 3 (второй обертон или третья гармоника) и т. д. Подробно колебательные спектры будут рассмотрены при изучении ИК-спектроскопии.
Электронные спектры
Верхней энергетической границей колебательного спектра обычно считают энергию фотонов примерно в 5000 см-1, или около 60 кДж/моль. Дальнейшее увеличение энергии облучающих квантов чаще всего будет приводить к возбуждению электронов и появлению в спектре полос, характеризующих электронные переходы, хотя, конечно, указанная граница может несколько смещаться в ту или другую сторону в зависимости от свойств изучаемого соединения.
Интерпретация электронных спектров может быть сделана на основе квантово-механических представлений, например метода молекулярных орбиталей (МО). В соответствии с основными положениями этого метода электроны в молекуле могут находиться на связывающих, несвязывающих и разрыхляющих орбиталях. Схема относительного расположения энергетических уровней, соответствующих разным МО, показана на рис. 5. Различные электронные переходы требуют неодинаковой энергии, поэтому полосы поглощения располагаются при разных длинах волн.
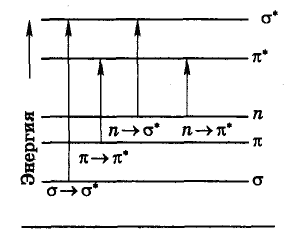
Рисунок 5 Схема электронных уровней и энергия возможных электронных переходов
Наибольшей энергии требует —>*-переход, связанный с возбуждением внутренних электронов. Он соответствует поглощению в далекой ультрафиолетовой области ( < 200 нм, Е > 600 кДж/моль). Такие переходы характерны, например, для метана, этана и других насыщенных углеводородов. Переход n—* связан уже с меньшими затратами энергии. Полосы, вызванные этим переходом, расположены в обычном (невакуумном) ультрафиолете (= 200—300 нм). Еще меньшая энергия требуется для перехода на разрыхляющие *-орбитали. Переходы п—* и —>* встречаются в молекулах соединений с сопряженными связями и молекулах ароматических соединений. Этим же переходом можно объяснить, например, интенсивную окраску ионов MnO4- и CrO42- (переход с несвязывающей орбитали кислорода). Теоретический расчет энергии разных МО громоздок и связан с большими трудностями, поэтому существенное значение имеют различные эмпирические закономерности, связывающие спектр поглощения со строением и свойствами вещества.
Введение в молекулу различных заместителей или изменение внешних условий, например, растворите ля, обычно вызывает сдвиг полосы поглощения. Если полоса поглощения смещается в сторону более длинных волн, говорят о батохромном смещении или углублении окраски (красное смещение), а если полоса сдвигается в сторону более коротких волн, эффект называют гипсохромным сдвигом или повышением окраски (голубое или синее смещение). Кроме переходов внутри валентной оболочки, известны так называемые переходы Ридберга, связанные с изменением главного квантового числа. Полосы, соответствующие этим переходам, расположены в дальней ультрафиолетовой области.
Электронный переход обычно осложняется наложением колебательных, а иногда и вращательных переходов, так как каждое электронное состояние молекулы обладает набором колебательных (и вращательных) уровней (рис. 3.7). Основному электронному состоянию (I) отвечает система колебательных уровней, характеризуемая колебательными квантовыми числами V= 0, 1, 2, .... Возбужденное электронное состояние (II) обладает системой колебательных уровней с квантовыми числами V` = 0, 1, 2, .... У каждого колебательного состояния есть система вращательных уровней, энергия которых пропорциональна вращательному квантовому числу j.
При обычных условиях большинство молекул находится в основном электронном и основном колебательном состояниях. Переходы вp в этих условиях (см. рис. 6) характеризуют чисто вращательные спектры, линии которых появляются в самой далекой длинноволновой части ИК-спектра и области микроволн.
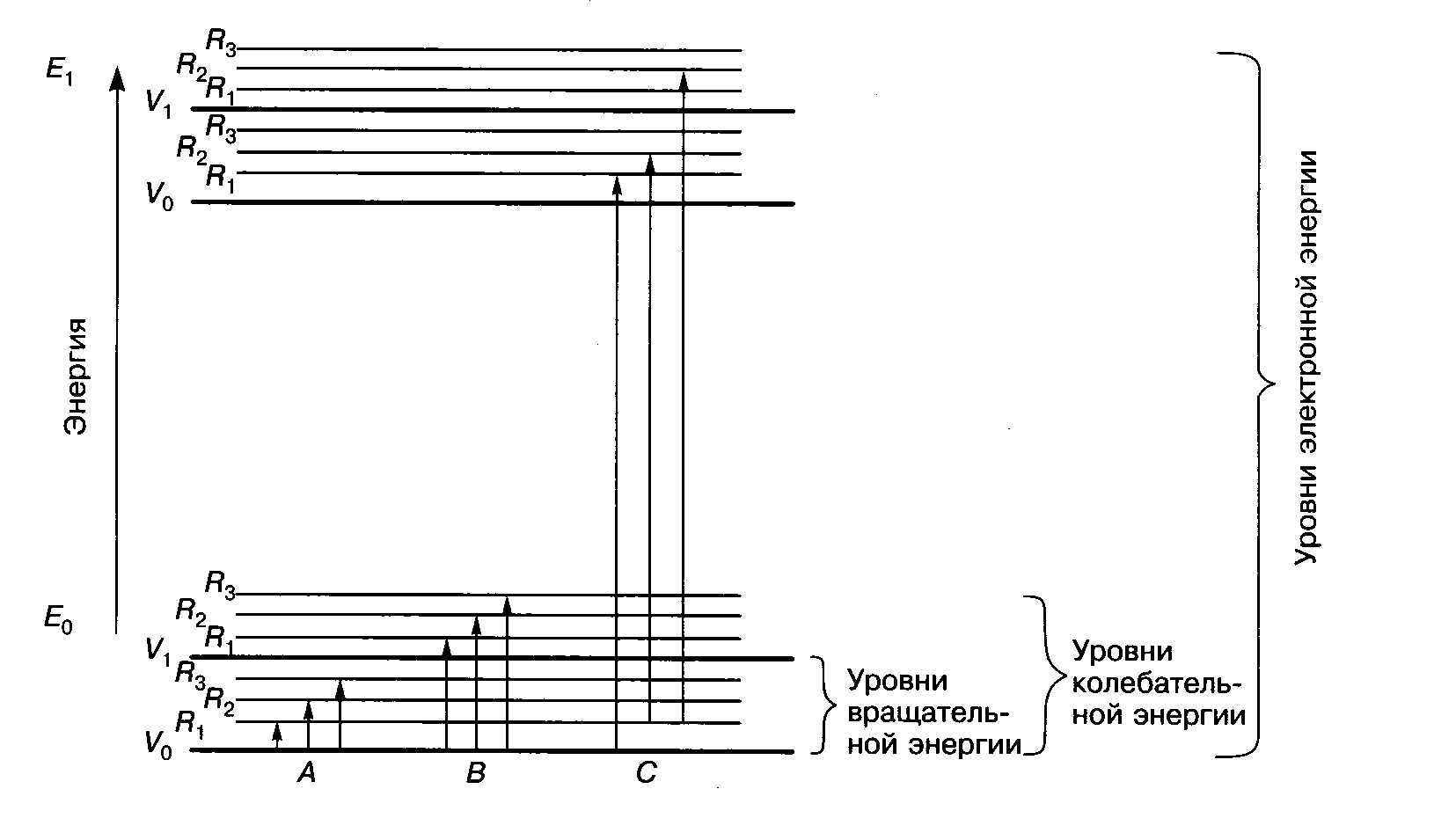
Рисунок 6 Схема энергетических уровней молекулы в основном (I) и первом возбужденном (II) электронных состояниях.
Чисто колебательные переходы кол (см. рис. 6) происходят при неизменном электронном состоянии молекулы. В случае разреженных газов наблюдаются колебательно-вращательные спектры молекул кол + вp, характеризующие переходы между вращательными уровнями различных колебательных состояний.
Электронные переходы являются наиболее сложными в связи с наложением колебательных, а при определенных условиях и вращательных переходов. Наложение большого числа колебательных переходов часто приводят к существенному уширению полос электронных спектров, так как колебательная структура не всегда разрешается. Известны и другие причины, вызывающие уширение полосы поглощения в электронных спектрах, связанные, например, с временем жизни возбужденного состояния. Изменение свойств электронной оболочки в результате электронного перехода приводит к изменению потенциальной энергии системы, поэтому кривая потенциальной энергии, например, двухатомных молекул в разных электронных состояниях не будет одинакова. В возбужденном состоянии обычно происходит увеличение равновесного межъядерного расстояния, уменьшение энергии диссоциации и изменение других свойств по сравнению со свойствами в основном состоянии. Обычные кривые потенциальной энергии молекулы в основном и возбужденном состояниях показаны на рис. 7.

Рисунок 7. Электронно-колебательный переход согласно принципу Франка-Кондона: 1 – основное, 2 – возбужденное состояние.
Существенное значение в электронной спектроскопии имеет принцип Франка—Кондона. При взаимодействии молекулы с квантом света электронная оболочка столь быстро переходит в возбужденное состояние, что положение ядер измениться не успевает. Таким образом, за время перехода молекулы в возбужденное состояние межъядерное расстояние меняться не будет. Однако в новом электронном состоянии равновесное межъядерное расстояние обычно отличается от того, которым обладала молекула в основном состоянии, и колебательные уровни возбужденного состояния также будут другими. Переход на колебательные уровни возбужденного электронного состояния дает информацию о колебательных уровнях этого состояния.
Неизменность межъядерного расстояния во время электронного перехода означает, что на кривых потенциальной энергии этот переход должен изображаться вертикальной линией, как это представлено на рис. 7. Колебательная структура спектра зависит от относительного смещения кривых потенциальной энергии. Так как наиболее вероятны переходы без изменения межъядерного расстояния, им и будут отвечать наиболее интенсивные полосы в спектрах поглощения. Принципу Франка—Кондона можно придать количественную форму. Использование принципа Франка—Кондона в спектроскопии многоатомных молекул также приводит к важным результатам, позволяя решить вопрос о типе колебаний и структуре молекул. В случае многоатомных молекул картина становится значительно более сложной, так как потенциальная энергия многоатомной молекулы может быть представлена уже не просто кривой, а поверхностью потенциальной энергии в n-мерном пространстве. (Если зафиксировать определенные координаты, потенциальную поверхность можно изобразить и в трехмерном пространстве.)
Интенсивность поглощения
Интенсивность полос в спектре поглощения характеризуют интегралом поглощения, или силой осциллятора, определяемой выражением
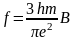
где В — коэффициент Эйнштейна, характеризующий вероятность перехода.
Коэффициент Эйнштейна связан с электрическим дипольным моментом перехода и некоторыми другими величинами.
Чем более вероятным является переход, тем больше сила осциллятора.
Для
аналитической характеристики соединений
имеет значение
не столько интегральное поглощение,
сколько светопоглощение
при определенной длине волны. Важными
аналитическими характеристиками
являются молярный коэффициент поглощения
в
точке максимума тах
и
полуширина
полосы поглощения
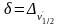 (рис.
8).
(рис.
8).
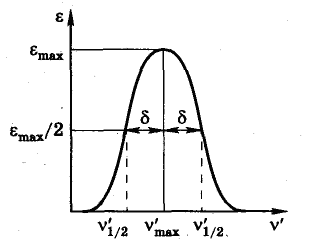
Рисунок 8. Полоса поглощения
Наибольшей интенсивностью в спектрах поглощения обладают полосы переноса заряда, т. е. полосы, обусловленные переносом электрона от одного атома к другому. Часто эти полосы связаны с переносом электрона с p-орбитали лиганда на d-орбиталь центрального иона и наоборот. Более правильно следует говорить о переносе электрона между молекулярными орбиталями, локализованными у разных атомов.
