
- •Методичні вказівки
- •12. Хімія неметалічних елементів
- •12.1. Загальна характеристика неметалів
- •12.2. Карбон та його неорганічні сполуки
- •12.3. Силіцій та його сполуки
- •12.4. Запитання та задачі для самоконтролю
- •13. Твердість води
- •13.1. Магній, Кальцій та їхні сполуки
- •13.2. Твердість води та методи її усунення
- •13.3. Запитання та задачі для самоконтролю
- •14. Неорганічні в'яжучі речовини
- •14.1. Загальні властивості
- •14.2. Гіпсові в'яжучі речовини
- •14.3. Вапняні в'яжучі речовини
- •14.4. Портландцемент
- •14.5. Корозія бетону. Методи захисту бетону від корозії
- •14.6. Запитання та задачі для самоконтролю.
- •15. Органічні сполуки
- •15.1. Загальна характеристика
- •15.2. Теорія хімічної будови органічних сполук о.М.Бутлерова
- •5.3.Класифікація
- •15.4. Номенклатура
- •15.5. Органічні полімерні матеріали в будівництві
- •15.5.1. Загальна характеристика
- •15.5.2. Класифікація
- •15.5.3. Методи одержання полімерів
- •15.5.4. Будова і властивості полімерів
- •15.5.5. Bикористання полімерних матеріалів у будівництві
- •15.6. Запитання та завдання для самоконтролю
- •Література
13. Твердість води
13.1. Магній, Кальцій та їхні сполуки
Магній Mg та Кальцій Са належать до головної підгрупи II групи елементів періодичної системи. У зовнішньому електронному шарі атомів елементів цієї підгрупи розміщується по два валентних s-електрона, отже, ці елементи є металами.
Поширення в природі. Вміст у земній корі Mg - 2,4%, Са - 2,96%. У вільному стані ці метали не зустрічаються. Найважливішими з магнієвих та кальцієвих мінералів є магнезит MgCО3, доломіт MgCO3∙CaCО3, азбест; вапняк, мармур, крейда, склад яких відповідає одній формулі CaCО3; гіпс CaSO4∙2H2O, ангідрит CaSO4.
Оксиди та гідроксиди магнію та кальцію. Оксиди цих металів у промисловості і лабораторії добувають термічним розкладанням відповідних карбонатів або гідроксидів.
Наприклад, під час нагрівання магнезиту утворюється оксид магнію (палена магнезія):
![]()
MgO має температуру плавлення 2800°С. Сильно прожарений MgO дуже твердий, не розчиняється у воді та кислотах, його використовують для виготовлення різних вогнетривких виробів і штучних будівельних матеріалів— ксилоліту та фіброліту, а також для одержання магнезіального в'яжучого (магнезіального цементу), який утворюється згідно з рівнянням:
MgO+MgCl2+H2O → 2MgOHCl.
Магнезіальний цемент—в'яжучий матеріал, використовується для виготовлення точильних каменів, млинових жорен.
Оксид кальцію одержують розкладанням вапняку СаСО3 за температури 900°С:
![]()
СаО відомий під назвою негашене, або палене вапно. Після гашення водою утворюється гашене вапно:
СаО + Н2О → Са(ОН)2.
Гашене вапно застосовується у будівництві та у виробництві соди. Суміш гашеного вапна, піску та води називається будівельним розчином.
Солі магнію та кальцію. З солей магнію та кальцію найбільше застосовують карбонати і сульфати цих металів.
Карбонат кальцію СаСО3, наприклад, мармур — цінний будівельний матеріал. Великі кількості вапняку та крейди застосовують у цементній та скляній промисловості. Термічним розкладанням вапняку добувають негашене вапно та вуглекислий газ. Магнезит MgCO3 використовують для добування оксиду магнію.
Термічним розкладанням сульфату кальцію у вигляді мінералу гіпсу CaSO4·2H2O одержують будівельний гіпс (алебастр)
![]()
Під час змішування з водою алебастр знову перетворюється на тверду масу — двоводний гіпс CaSO4∙2H2O.
13.2. Твердість води та методи її усунення
Твердість води зумовлюють катіони Са2+, Mg2+ та катіони деяких важких металів. Оскільки в природних водах переважають іони Са2+ і Mg2+, а інші присутні не завжди і в незначних кількостях, то загальна твердість природних вод може бути охарактеризована сумою концентрацій іонів Са2+ та Mg2+ (ммоль∙екв/л). Один ммоль∙екв відповідає вмісту у воді 20,04 мг/л іонів Са2+ або 12,156 мг/л іонів Mg2+.
Твердість природних вод змінюється в широких межах. За величиною загальної твердості природні води поділяються на груди: вода дуже м'яка (менше ніж 1,5 ммоль∙екв/дм3), вода м'яка (від 1,5 до 3,0 ммоль∙екв/дм3), вода середньої твердості (від 3,0 до 5,4 ммоль∙екв/дм3), вода тверда (від 5,4 до 10,7 ммоль∙екв/дм3), вода дуже тверда (понад 10,7 ммоль∙екв/дм3).
Найбільш м'якими є води атмосферних осадів, твердість яких становить 0,07 - 0,1 ммоль∙екв/дм3. Найбільша твердість спостерігається в водах світового океану, для яких середнє значення твердості дорівнює 130,5 ммоль∙екв/дм3. Припустима твердість вода для господарчо-питного водопостачання становить не більше, ніж 7 ммоль∙екв/дм3.
Загальна твердість поділяється на карбонатну і некарбонатну. Перша з них зумовлена присутністю гідрокарбонатів та карбонатів кальцію і магнію (Са(НСО3)2, Mg(HCO3)2, СаСО3, MgCO3). Оскільки карбонати кальцію та магнію важкорозчинні речовини, то часто під карбонатною твердістю розуміють гідрокарбонатну твердість, зумовлену добре розчинними гідрокарбонатами Са(НСО3)2, Mg(HCO3)2. Ці солі при нагріванні розкладаються з виділенням оксиду Карбону (IV) і осаду карбонатів. Таким чином, при кип'ятінні твердість води, спричинена гідрокарбонатами кальцію та магнію, усувається. Тому така твердість називається усувною або тимчасовою.
Сульфати, хлориди, а також кальцієві та магнієві солі інших кислот характеризують некарбонатну або постійну твердість води. Солі, що зумовлюють твердість води, не шкідливі для живих організмів, однак наявність їх у великих кількостях небажана, оскільки вода стає непридатною для господарчо-побутових потреб. Тверда вода не дає піни з милом, оскільки розчинні натрієві солі жирних кислот, що входять до складу мила, переходять у нерозчинні кальцієві солі цих кислот.
У твердій воді погано розварюються овочі, крупи, м'ясо, скорочується термін служби тканин, утворюються осади у водопровідних трубах та ін. Тверду воду неможна використовувати у деяких технологічних процесах, наприклад, при фарбуванні. Вода, що містить солі твердості, цілком непридатна для постачання парових котлів через утворення накипу, що призводите до перегріву котла і сприяє його швидкому руйнуванню. Вода з підвищеною тимчасовою твердістю непридатна для охолодження теплообмінної апаратури, оскільки при нагріванні гідрокарбонати кальцію та магнію розкладаються до карбонатів, які осідають на стінках теплообмінника.
Наведені приклади вказують на необхідність видалення з води, що використовується з технічною метою, солей кальцію та магнію. Цей спосіб водопідготовки називають водопом'якшенням. Зниження концентрації іонів Са2+ і Mg2+ можна досягти термічними, реагентними та іонообмінним методами.
При кип'ятінні води усувається переважно тимчасова твердість через виділення осадів СаСО3 та MgCО3:
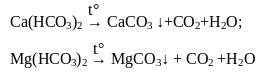
Крім того, частково усувається також сульфатна твердість, оскільки розчинність CaSO4 зменшується при підвищенні температури.
Такі методи як виморожування та дистиляція дозволяють позбутися не тільки солей твердості а і взагалі знесолити воду.
Реагентні методи пом'якшення води засновані на переведенні іонів Са2+ і Mg2+ у важкорозчинні сполуки (карбонати, фосфати та інші). 3 цією метою використовують вапно, соду, фосфати, поліфосфати та ін.:
Са(ОН)2 + Са(НСО3)2 → 2CaСО3 ↓ + 2H2O
Na2CO3 + СаС12 → СаСО3↓ + 2NaCl
2Na3РО4 + ЗСа(НСО3)2 → Са3(РО4)2↓ + 6NaHCO3.
Іонообмінний метод пом'якшення води полягає в обміні іонів Са2+, Mg2+ та інших металів, що знаходяться у воді, на іони Н+ або Na+, що входять до складу іоногенних груп катіонітів
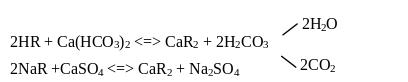
Оскільки іонний обмін — оборотний процес, то відновити обмінні властивості катіонну можна, пропускаючи розчини NaCl або НСl через шар катіоніту, який насичений іонами Са2+, Mg2+ або інших металів.
Якщо природну воду пропустити не тільки через Н-катіоніт, а ще й через ОН--аніоніт, то можна позбутися всіх катіонів металів і аніонів, розчинених у воді, тобто повністю знесолити воду.
Приклад 1. Обчисліть загальну(ТЗ), карбонатну(ТК) і не карбонатну(ТН) твердість води: а) якщо на титрування 100 см3 води витрачено 7,6 см3 розчину комплексону ІІІ з молярною концентрацією 0,1 моль/дм3; б) якщо на титрування 100 см3 води витрачено 2,5 см3 розчину HCl з молярною концентрацією 0,1 моль/дм3.
Розв’язання. Загальну і карбонатну твердість обчислюють по формулі
![]()
де С(Х)- молярна концентрація титранту (розчинів комплексона III або НСl), моль/см3;
V(X) - об'єм титранту (розчинів комплексона III або НСl), моль/см3;
Тоді
![]() ммоль/дм3.
ммоль/дм3.
![]() ммоль/дм3.
ммоль/дм3.
ТЗ = ТН + ТК
ТН = 7,6 – 2,5 = 5,1 ммоль/дм3.
Приклад 2. Яку масу карбонату натрію необхідно додати до 1 м3 води для усунення жорсткості, рівної 5 ммоль/дм3?
Розв’язання. В 1 м3 води міститься 1000·5 = 5000 ммоль еквівалентів солей, що зумовлюють жорсткість води. Мольна масса еквівалента карбонату натрію:
![]() (г/моль).
(г/моль).
Для усунення твердості до 1 м3 води слід додати карбонату натрію:
5000·53 = 265000 мг (або 265 г).
Приклад 3. Обчисліть твердість води, знаючи, що в 500 л її міститься 202,5 г Са(НСО3)2.
Розв’язання. В 1 л води міститься 202,5:500=0,405 г Са(НСО3)2, що складає 0,405:81=0,005 еквівалентних мас або 5 мекв/л [81 г/моль — еквівалентна маса Са(НСО3)2]. Отже, твердість води 5 мекв.
Приклад 4. Скільки грамів CaSO4 міститься в 1 м3 води, якщо твердість, обумовлена присутністю цієї солі, дорівнює 4 мекв?
Розв’язання. Мольна маса CaSO4 136,14 г/моль; еквівалентна маса дорівнює 136,14:2=68,07 г/моль. В 1 мл води твердістю 4 мекв міститься 4·1000=4000 мекв, або 4000·68,07=272,280 мг = 272,280 г CaSO4.
Приклад 5. Яку масу соди треба додати до 500 л води, щоб усунути її твердість, яка дорівнює 5 мекв?
Розв’язання. В 500 л води міститься 500·5=2500 мекв солей, що обумовлюють твердість води. Для усунення твердості слід додати 2500·53=132500 мг = 132,5 г соди (53 г/моль - еквівалентна маса Na2CO3.
Приклад 6. Обчисліть карбонатну твердість води, знаючи, що на титрування 100 см3 цієї води, що містить гідрокарбонат кальцію, потрібно було 6,25 см3 0,08 н. розчину НС1.
Розв’язання. Обчислюємо нормальність розчину гідрокарбонату кальцію. Позначивши число еквівалентів розчиненої речовини в 1 л розчину, тобто нормальність, через х, складаємо пропорцію:
![]()
Таким чином, в 1 л досліджуваної води міститься 0,005·1000=5 мекв гідрокарбонату кальцію або 5 мекв Са2+-іонів. Карбонатна твердість води 5 мекв. Наведені приклади розв’язують, застосовуючи формулу
Т = m/ЕV
де т - маса речовини, що зумовлює твердість води або вживаного для усунення твердості води, мг; Е - еквівалентна маса цієї речовини; V - об'єм води, л.
Розв’язання прикладу 1. Т = m/ЕV = 202500/81·500=5 мекв. 81 - еквівалентна маса Са(НСО3)2, яка дорівнює половині його мольної маси.
Розв’язання прикладу 2. З формули Т = m/ЕV, m=4·68,07·1000=272280 мг = 272,280 г CaSO4.
