
4.3 Скорость химических реакций
Химическая кинетика - это раздел химии, рассматривающий скорости и механизмы химических процессов.
Скорость химических реакций показывает число химических взаимодействий, приводящих к образованию продукта реакции, в единице объема или на единице поверхности за единицу времени. Различают среднюю скорость V и истинную (или мгновенную) Vист скорость реакции.
Средняя
скорость:  [моль/л
с]
[моль/л
с]
где С1, С2 - концентрации реагирующего вещества, [моль/л];
t1, t2 - время, [с].
Истинная скорость определяется производной концентрации по времени:
Vист=
Закон действия масс. При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции (если уравнение реакции точно отражает ее ход). Для реакции: a A+b B = c C + d D математическое выражение закона действия масс имеет вид:
V=k [A]a [B]b
где V - скорость реакции; к - константа скорости, [А], [В] - концентрации веществ А и В; а, b - стехиометрические коэффициенты в уравнении реакции.
Константа скорости к химической реакции определяется природой реагирующих веществ, зависит от температуры и присутствия катализаторов, но не зависит от концентрации реагирующих веществ.
Теория активных столкновений. В основе теории активных столкновений лежат положения молекулярно - кинетической теории газов и предположение об энергетическом барьере, численно равном энергии активации.
Необходимым условием химического взаимодействия молекул является их столкновение. Однако, далеко не каждое столкновение частиц приводит к химическому взаимодействию. Последнее происходит в том случае, когда частицы приближаются на расстояние, при котором становится возможным перераспределение электронной плотности и возникновение новых химических связей. Следовательно, сталкивающиеся частицы должны обладать энергией, достаточной для преодоления сил отталкивания (преодоления энергетического барьера), возникающего между их электронными оболочками. Такие реакционно способные частицы называются активными, а энергия, необходимая для преодоления энергетического барьера, - энергией активации.
Энергия активации - это избыточное количество энергии, которым должна обладать молекула в момент столкновения, чтобы быть способной к химическому взаимодействию.
Теория переходного состояния (активированного комплекса).
Как показали исследования, в ходе реакции система проходит через переходное состояние, через образование так называемого активированного комплекса. Группировку активных частиц, находящихся в процессе взаимодействия, т.е. перераспределения связей, называют активированным комплексом.
Рассмотрим процесс образования молекулы HJ по реакции: Н2 + J2 = 2HJ. Активные молекулы Н2 и J2 при столкновении объединяются в промежуточные комплексы H2-J2.
Н-Н Н...Н Н Н
+  : :
I
I
: :
I
I
J - J J... J J J
Исходные активированный продукты
Молекулы комплекс реакции
В этом комплексе связи H-J начинают образовываться одновременно с разрывом связей Н-Н, J-J. В результате энергия активации 168 кДж, оказывается меньше, чем энергия в 571 кДж, необходимая для полного разрыва связей в исходных молекулах. Путь реакции через образование активированного комплекса энергетически более выгоден, поэтому большинство реакций и проходит через образование промежуточных активированных комплексов. Переход от исходных веществ Н2 и J2 к продукту реакции HJ через состояние активированного комплекса представлен на рис.11:
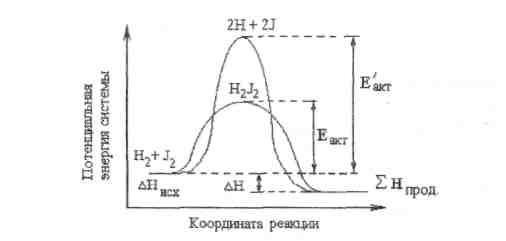
Рис. 11. Энергетическая диаграмма для реакции образования HJ.
Чем выше численное значение энергии активации, тем меньше в реакционной смеси активных молекул, тем меньше число эффективных
соударений и тем, следовательно, ниже константа скорости и сама скорость химической реакции.
Высокая энергия активации является причиной того, что многие химические реакции при стандартных условиях не протекают, хотя для них G<0, т.е. они принципиально возможны. Так, например, самопроизвольно не загораются: дерево, бумага, уголь, хотя энергия Гиббса реакций окисления этих веществ ниже нуля.
Кроме энергии активации, важным условием осуществления химической реакции является подходящее расположение молекул в момент столкновения. Вероятность надлежащей ориентации при столкновении характеризуется энтропией активации Sакт.
Sакт.=
Таким образом, для прохождения реакции необходимо, чтобы молекулы при столкновении были определенным образом ориентированы и обладали необходимой энергией.
Зависимость скорости реакции от температуры, энергии активации, энтропии активации определяется следующим выражением для к скорости:

где Z - общее число столкновений между молекулами в секунду.
Вероятность
того, что столкнувшиеся молекулы будут
иметь достаточную энергию взаимодействия,
пропорциональна eEакт RT,
вероятность же их нужной ориентации
в момент соударения пропорциональна
eSакт
R
RT,
вероятность же их нужной ориентации
в момент соударения пропорциональна
eSакт
R
