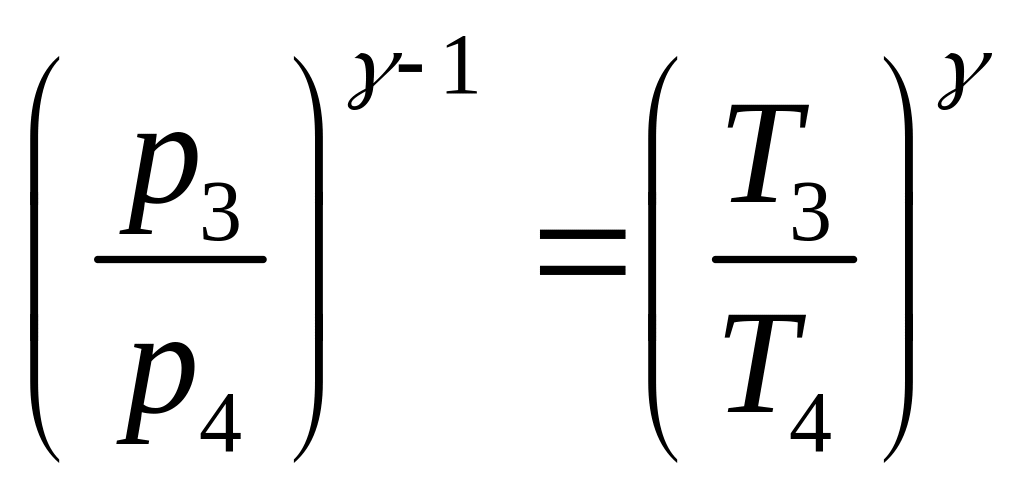Введение.Теплоемкость идеального газа.
Для характеристики макроскопических тепловых свойств систем пользуются особым параметром – теплоёмкостью системы.
Теплоёмкость C термодинамической системы численно равна количеству теплоты dQ, которое необходимо передать системе (или отвести от неё), чтобы изменить её температуру T на 1 К (или 1 °С); точнее – это отношение количества теплоты, поглощаемой телом при бесконечно малом изменении его температуры, к этому изменению:
|
(1) |
где dQ – переданное системе количество теплоты, dT – бесконечно малое изменение температуры.
Удельной теплоёмкостью вещества c называется величина, равная количеству теплоты, которую необходимо сообщить единице массы вещества для увеличения ее температуры на 1 К:
|
(2) |
где m – масса.
Для газов удобно пользоваться молярной теплоёмкостью Cm – количеством теплоты, необходимым для нагревания одного моля данного вещества на 1 К:
|
(3) |
где
µ – молярная масса вещества;
![]() –
количество молей вещества; c –
удельная теплоёмкость.
–
количество молей вещества; c –
удельная теплоёмкость.
Молярная теплоёмкость в системе СИ измеряется в Дж·моль–1·К–1 (в дальнейшем молярную теплоемкость будем обозначать С).
Теплоёмкость газов зависит от строения молекулы данного газа – числа атомов в молекуле и их взаимного расположения, т. е. от количества степеней свободы данной молекулы. С другой стороны, теплоемкость зависит от типа термодинамического процесса.
Число степеней свободы i в механике – это число независимых координат, определяющих положение механической системы в пространстве, причем таких, по которым элементы системы могут двигаться. Например, поршень в цилиндре может двигаться только по оси цилиндра, поэтому у него одна степень свободы. В соответствии с характером этого движения различают поступательные, вращательные и колебательные степени свободы.
При определении числа степеней свободы для молекулы ее можно рассматривать как систему материальных точек – атомов.
Для одноатомной молекулы i = 3 (три поступательные степени свободы, соответствующие перемещениям вдоль осей X, Y и Z).
Для двухатомной молекулы (например, N2 или H2) с жёсткой внутренней связью между атомами, т. е. при неизменном расстоянии между атомами вдоль оси Y, i = 5 (три поступательные степени свободы её центра инерции и две вращательные, соответствующие вращениям вокруг осей X и Z). Вращение вокруг оси Y для такой модели молекулы не приводит ни к каким изменениям.
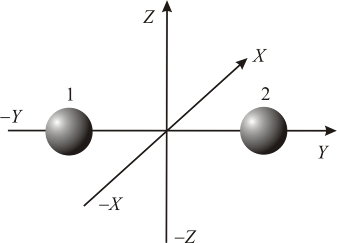
Рис. 1. Модель молекулы двухатомного газа
Для трёхатомной молекулы с жёсткими связями i = 6 (три поступательных и три вращательных степени свободы).
В
классической статистической физике
показано (закон
равнораспределения энергии по степеням
свободы),
что на каждую степень свободы приходится
в среднем энергия
![]() (где k –
постоянная Больцмана; T –
абсолютная температура).
(где k –
постоянная Больцмана; T –
абсолютная температура).
Для молекул с упругой связью между атомами необходимо учесть колебательные степени свободы. Так как колебательное движение характеризуется наличием и потенциальной, и кинетической энергий, средние значения которых равны, то на каждую колебательную степень свободы в среднем приходится энергия в 2 раза больше. Однако при обычных (комнатных) температурах колебательные степени свободы не вносят вклад в теплоёмкость многоатомного газа, они выключены («заморожены»), так как могут возбуждаться лишь при достаточно высоких температурах.
|
(4) |
Таким образом, средняя энергия E молекулы равна:
|
(5) |
где i – сумма возможных степеней свободы молекулы; k – постоянная Больцмана; T – температура.
В соответствии с первым началом термодинамики количество теплоты dQ, подводимое к газу, может расходоваться на увеличение внутренней энергии газа dU и на совершение термодинамической работы dA при расширении газа:
|
(6) |
Увеличение внутренней энергии идеального газа в случае изменения его температуры на dT рассчитывается по формуле:
|
(7) |
где R – универсальная газовая постоянная (R ≈ 8,31 103 Дж·кмоль–1·К–1).
При расширении газа система выполняет работу dA:
dA = pdV. |
(8) |
Величина теплоёмкости существенно зависит от того, при каких условиях нагревался газ.
1. Изохорический процесс, протекающий при постоянном объёме системы, V = const. В этом случае работа по расширению газа отсутствует (ΔV =0, поэтому A = pΔV = 0) и dQ = dU, следовательно, молярная теплоёмкость газа при постоянном объёме CV:
|
(9) |
2. Изобарический процесс, протекающий при постоянном давлении системы, p = const. В этом случае работа не равна нулю.
Тогда
|
(10) |
где Cp – молярная теплоёмкость газа при постоянном давлении.
Итак, при нагревании при постоянном давлении часть теплоты идёт на производство работы расширения тела, а часть – на увеличение его внутренней энергии, тогда как при нагревании при постоянном объёме вся теплота расходуется на увеличение внутренней энергии, и Cp всегда больше, чем CV.
Используя уравнение состояния идеального газа (уравнение Менделеева–Клапейрона):
|
(11) |
можно показать, что для одного моля газа:
|
(12) |
Поэтому уравнение (10) можно переписать в виде формулы Мáйера:
|
(13) |
Тогда, разделив Cp на CV, получим:
|
(14)
|
Величина γ имеет самостоятельный смысл в термодинамике, она входит в уравнение описывающие адиабатический процесс - уравнение Пуассóна, называется показателем адиабаты или коэффициентом Пуассóна.
Адиабатический процесс - это процесс, протекающий без теплообмена системы с окружающей средой, dQ = 0. На практике адиабатическими процессами являются те процессы, которые протекают очень быстро, и теплообмен с окружающей средой не успевает произойти, или же процессы, протекающие в системах, находящихся в термостате (например в термосе). Уравнение адиабаты:
|
(15) |
Это - уравнение Пуассона. С учетом уравнения Клапейрона - Менделеева уравнение можно переписать, используя другие параметры состояния идеального газа (всюду ν =const):
|
(16) |
|
(17) |
как видно из (14), γ для любого идеального газа зависит только от числа степеней свободы его молекул.
Табл. 1. Число степеней свободы для некоторых молекул
Молекула |
Связь между атомами |
Число степеней свободы |
i |
Cp/CV |
||
Пост. |
Вр. |
Кол. |
|
|
||
Одноатомная |
- |
3 |
0 |
0 |
3 |
1,67 |
Двухатомная |
Жёсткая |
3 |
2 |
0 |
5 |
1,40 |
Упругая |
3 |
2 |
1 |
6 |
1,291 |
|
Трёхатомная |
Жёсткая |
3 |
3 |
0 |
6 |
1,33 |
Впервые измерение отношения теплоёмкостей для газов было осуществлено французскими химиками Н. Клемáном и Ш. Дезóрмом в 1819 г, метод основывается на изучении параметров некоторой массы газа, переходящей из одного состояния в другое двумя последовательными процессами – адиабатическим и изохорическим.
Лабораторная работа 9
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЁМКОСТЕЙ ГАЗОВ МЕТОДОМ АДИАБАТИЧЕСКОГО РАСШИРЕНИЯ (МЕТОДОМ КЛЕМАНА И ДЕЗОРМА)
Цели и задачи работы
Изучение термодинамических процессов в воздухе.
Определение показателя адиабаты γ для воздуха адиабатическим методом Клемана и Дезорма.
Ф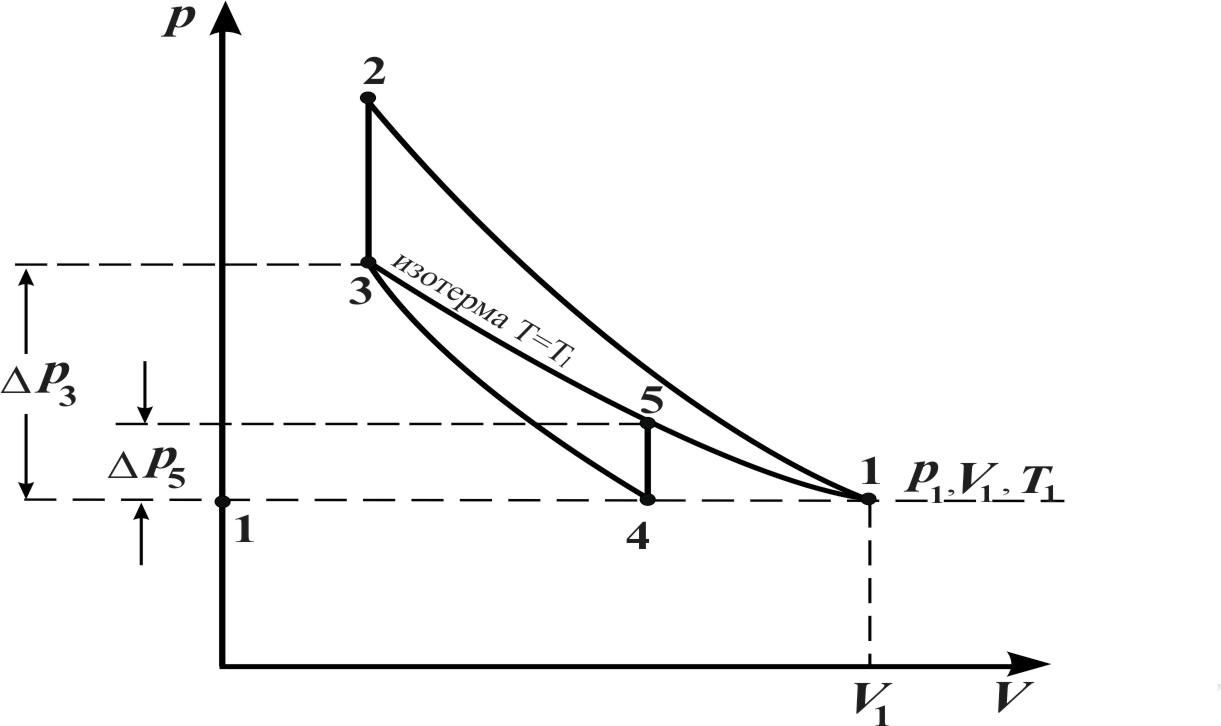 изическое
обоснование эксперимента
изическое
обоснование эксперимента
|
Рис. 9.1. pV-диаграмма процессов в газе: 3-4 – адиабатический процесс; 2-3 и 4-5 – изохорические процессы |
Выделим мысленно в сосуде некоторую порцию газа (ν молей), и в дальнейшем будем рассматривать изменения происходящие только с этой порцией.
Исходное состояние 1 характеризуется параметрами p1, V1 и T1, где p1 - атмосферное давление, T1 – комнатная температура.
Накачаем в сосуд воздух (процесс 1-2). При этом газ в сосуде сожмётся и нагреется (состояние 2).
После отключения сосуда от насоса (перекрывания крана) газ будет остывать до комнатной температуры при постоянном объеме (изохорический процесс 2-3). Соответственно примет объем V3 (V3= V2), и температуру Т3 (Т3 =Т1). в состоянии 3 давление p3 установится больше атмосферного на Δp3. Последняя величина определяется по разности уровней подкрашенной жидкости h1 в коленах манометра М.
Если теперь на короткое время соединить баллон с атмосферой, то произойдёт быстрое, а, следовательно, адиабатическое расширение воздуха (процесс 3-4). При этом давление понизится до атмосферного p4 = p1. Рассматриваемая масса воздуха, займет объём V4. При этом температура воздуха понизится до Т4 < T1.
Поскольку процесс 3-4 – адиабатический, к нему можно применить уравнение Пуассона:
|
(9.1) |
Или в соответствии с формулой 17
|
(9.2) |
Это уравнение можно переписать в виде:
|
|
Учитывая, что p4 = p1, p3= p1+ Δp3, а Т3 =Т1 получаем:
|
(9.3) |
После адиабатического расширения воздух в баллоне будет нагреваться (процесс 4-5) до температуры окружающей среды Т5 = Т1 при постоянном объёме V5 = V4. При этом давление в баллоне поднимется до (p5 = p1 + Δp5). Изменение давления Δp5 можно определить по разности уровней подкрашенной жидкости h2 в коленах манометра М. Поскольку процесс 4-5 – изохорический, к нему можно применить закон Шарля:
|
(9.4) |
Сопоставив уравнения 9.3 и 9.4, получим:
|
(9.5) |
Прологарифмируем:
|
(9.6) |
Поскольку избыточные давления Δp3 и Δp5 малы по сравнению с атмосферным давлением p1 и, учитывая, что для натуральных логарифмов ln(1 + x) ≈ x при x << 1, будем иметь:
|
(9.7) |
откуда
|
(9.8) |