
Лекции 2, 16
.pdf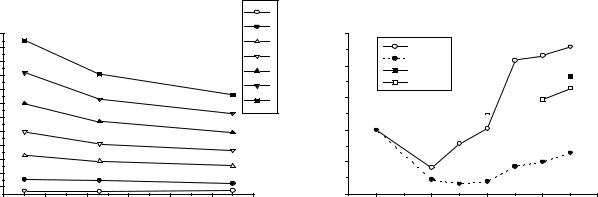
2Л16. Химия элементов VII-Б группы.
|
Mn |
Tc |
Re |
|
|
|
|
N пп |
25 |
43 |
75 |
|
|
|
|
rмет. (к.ч.12), пм |
124 |
135,8 |
137 |
r MVII, пм |
46 |
56 |
60 |
r MVI, пм |
50 |
- |
61 |
r MV, пм |
52 |
60 |
62 |
r MIV, пм |
52 |
72 |
72 |
r MIII, пм |
58(н.с.),64,5(в.с.) |
64,5 |
- |
r MII, пм |
91 |
95 |
- |
Тпл., оС |
1244 |
2200 |
3180 |
Ткип., оС |
2060 |
4567 |
~5650 |
∆Hoпл., кДж/моль |
13,4 |
23,8 |
34 |
|
|
|
|
∆Hoисп., кДж/моль |
221(8) |
585 |
704 |
|
|
|
|
∆Hoат., кДж/моль |
281(6) |
- |
779(8) |
|
|
|
|
d, г/см3 |
7,43 |
11,5 |
21,0 |
ρ, µом•см-1 |
185 |
- |
19,3 |
|
|
|
|
решетка |
(α)ОЦК |
ГПУ |
ГПУ |
|
|
|
|
|
|
|
|
|
|
|
I1 |
|
|
|
|
|
|
12000 |
|
|
|
|
|
I2 |
6 |
|
|
|
|
|
11000 |
|
|
|
|
|
I3 |
|
Mn(pH=0) |
|
|
|
|
10000 |
|
|
|
|
|
I4 |
4 |
Mn(pH=14) |
|
|
|
|
9000 |
|
|
|
|
|
I5 |
Tc (pH=0) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
8000 |
|
|
|
|
|
I6 |
|
Re (pH=0)) |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
||
кДж/моль |
7000 |
|
|
|
|
|
I7 |
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|||
5000 |
|
|
|
|
|
nE- |
|
|
|
|
||
|
6000 |
|
|
|
|
|
в , |
|
|
|
|
|
|
|
|
|
|
|
o |
|
|
|
|
|
|
I, |
|
|
|
|
|
|
|
|
|
|
|
|
|
4000 |
|
|
|
|
|
|
|
|
|
|
|
|
3000 |
|
|
|
|
|
|
-2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2000 |
|
|
|
|
|
|
|
|
|
|
|
|
1000 |
|
|
|
|
|
|
-4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20 |
30 |
40 |
50 |
60 |
70 |
80 |
0 |
2 |
4 |
6 |
8 |
|
|
|
|
N пп |
|
|
|
|
|
ст.окисления |
|
|
Рис.1. Изменение потенциалов иони- |
Рис.2. Диаграммы Фроста для |
зации для элементов VII-Б группы. |
элементов VII-Б шруппы. |
|
|
|
|
MnO2 |
|
|
|
|
Re2O7 |
|
|
|
|
|
|
|
O2 |
|
|
|
|
|
O2 |
|
|
|
|
HNO3 |
Mn |
Cl2 |
|
HNO3 |
|
|
Cl |
|
||
|
|
|
|
|
|
|||||||
Mn(NO3)2 |
|
|
|
|
MnCl2 |
HReO4 |
Re(Tc) |
2 |
ReCl6 |
|||
|
HCl |
|
||||||||||
|
|
|
||||||||||
|
|
|
|
|||||||||
|
|
|
|
|
|
H2O2 |
|
|
||||
|
MnCl2 |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
HReO4 |
|
|
||
|
|
|
|
|
|
|
|
|
|
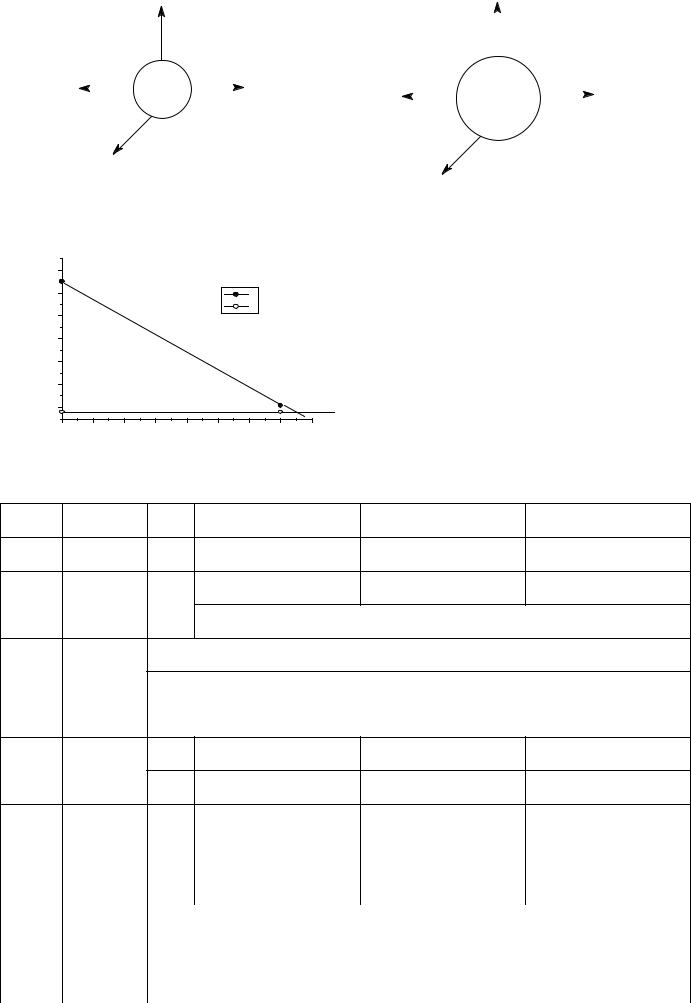
3MnO42- + 2H2O 2MnO4- + MnO2 |
||||
|
1.8 |
|
|
|
|
|
|
|
|
+4OH- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.6 |
|
|
|
|
|
|
|
|
2- |
|
|
+ |
- |
|
|
|
|
|
|
1) |
|
|
3MnO4 |
+4H →2MnO4 + MnO2+ 2H2O |
||||
|
|
|
|
|
|
|
|
|
||||||
|
1.4 |
|
|
|
|
|
2) |
|
|
1) MnO42-+2H2O+2e→MnO2+4OH- |
||||
|
|
|
|
|
|
|
|
|
||||||
в |
1.2 |
|
|
|
|
|
|
|
|
|||||
E, |
|
|
|
|
|
|
|
|
|
|
2- |
-e |
→ MnO4 |
- |
|
1.0 |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
2) MnO4 |
|
|||
|
0.8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0.6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
|
|
|
|
|
|
|
|
|
|
pH |
|
|
|
|
|
|
|
|
|
ст.ок. эл.конф. |
к.ч. |
|
|
|
Mn |
|
|
|
Tc |
Re |
||||
0 |
|
d7 |
|
6 |
|
Mn2(CO)10 |
|
Tc2(CO)10 |
|
Re2(CO)10 |
||||
+1 |
|
d6 |
|
6 |
|
Mn(CO)5Cl |
|
Tc(CO)5Cl |
|
Re(CO)5Cl |
||||
|
|
|
|
|
|
K5[Mn(CN)6] |
|
|
|
|
|
|
||
+2 |
|
d5 |
|
6 |
|
[Mn(H2O)6]2+ |
|
|
|
|
|
|
||
|
|
|
|
4 |
|
MnCl42- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tc2Cl83- |
|
|
|
|
+3 |
|
d4 |
|
6 |
|
Mn(acac)3 |
|
Tc(acac)3 |
|
Re2(ac)4Cl2 |
||||
|
|
|
|
(5) |
|
[Mn(H2O)6]3+ |
|
Tc2Cl82- |
|
|
Re2Cl82- |
|||
+4 |
|
d3 |
|
6 |
|
MnO2, MnX62- |
[Tc(acac)3]+ |
ReCl4,ReX62- |
||||||
|
|
|
|
|
,ReO2 |
|
|
|
|
TcX62- |
|
+5 |
d2 |
4 |
MnO43- |
|
|
|
|
5 |
|
TcF5 |
ReCl5, ReOX4- |
+6 |
d1 |
4 |
MnO42- |
|
|
|
|
6 |
|
TcF6 |
ReO3, ReF6 |
+7 |
d0 |
3 |
MnO3+ |
|
|
|
|
4 |
MnO4-, Mn2O7 |
TcO4-, Tc2O7 |
ReO4- |
|
|
6 |
|
|
Re2O7 |
|
|
8 |
|
|
KReF8 |
Свойства галогенидов элементов VII-Б группы.
ст.ок. |
F |
Cl |
Br |
I |
|
|
|
|
|
+7 |
ReF7,желт.,Тпл.= |
|
|
|
|
48,3, Ткип.=73,7 |
|
|
|
|
|
|
|
|
+6 |
TcF6, желт., Тпл.= |
|
|
|
|
37,4, Ткип.=55,3 |
|
|
|
|
|
|
|
|
|
ReF6, желт., |
ReCl6, кр.-зел., |
|
|
|
Тпл.= 18,5, |
Тпл.=29 |
|
|
|
Ткип.=33,7 |
|
|
|
|
|
|
|
|
+5 |
TcF5, желт. |
|
|
|
|
ReF5, желт.-зел., |
ReCl5, темн.- |
ReBr5, темн.-кор. |
|
|
Тпл.=48, Ткип.=221 |
кор., Тпл.=220 |
|
|
|
|
|
|
|
+4 |
MnF4, голубой |
|
|
|
|
|
TcCl4, красн. |
|
|
|
ReF4, голубой |
ReCl4, темн.-кор. |
ReBr4, темн. |
ReI4, темр. |
+3 |
MnF3, красный |
|
|
|
|
|
(ReCl3)3, темно- |
(ReBr3)3, кр.-кор. |
|
|
|
красн. |
|
|
|
|
|
|
|
+2 |
MnX2 |
|
|
|
|
(X=F,Cl,Br,I) |
|
|
|
|
|
|
|
|
|
|
|
o |
o |
|
|
|
|
|
|
|
|
|
|
|
o |
|
|
|
2,36 |
|
|
|
|
|
|
o |
|
|
|
|
o |
|
|
o |
|
|
||
2,66 o |
2,49 |
|
o |
2,39 |
|
|
|
o |
|
|
|
|
|
||
|
|
o |
|
|
o |
|
|
|
|
|
o |
|
|
|
|
o |
|
|
|
|
|
||
|
|
o |
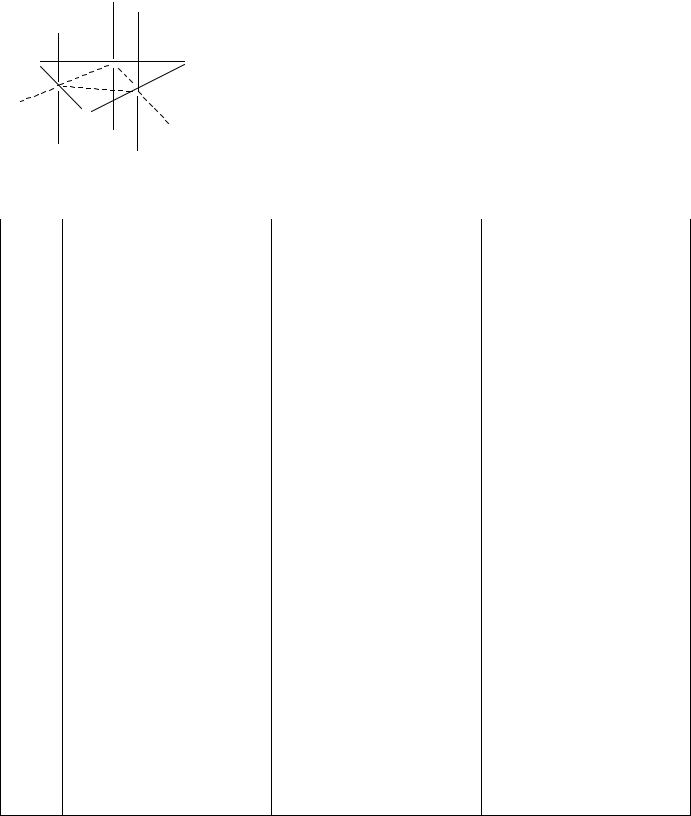
Рис.3. Строение (ReCl3)3. |
|
|||
|
|
|
|
|
|||
|
|
|
|
|
|
||
Свойства оксогалоггенидов Mn, Tc, Re. |
|
||||||
|
|
|
|
|
|
|
|
ст.ок. |
|
|
|
F |
Cl |
Br |
|
|
|
|
|
|
|||
+7 |
|
MnO3F, т.-зел.,Тпл.= - |
MnO3Cl, желтый |
|
|||
|
|
78 Ткип.=60 |
|
|
|||
|
|
|
|
|
|||
|
|
TcO3F, желт., |
TcO3Cl, б.ц. |
|
|||
|
|
Тпл.=18,3, Ткип.=~100 |
|
|
|||
|
|
|
|
|
|||
|
|
ReOF5, красный, |
|
|
|||
|
|
Тпл.=43,8, Ткип.=73 |
|
|
|||
|
|
|
|
|
|||
|
|
ReO2F3, желт., Тпл.=90, |
|
|
|||
|
|
Ткип.=185 |
|
|
|
||
|
|
|
|
|
|||
|
|
ReO3F, желт., |
ReO3Cl, б.ц., Тпл.=4,5, |
ReO3Br, |
|||
|
|
Тпл.=147, Ткип.=164 |
Ткип.=13 |
|
|||
|
|
|
|
|
|||
+6 |
|
TcOF4, голубой, Тпл.= |
MnO2Cl2, желтый |
|
|||
|
|
134, Ткип.=165 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
TcOCl4, голубой |
|
|
|
ReOF4, голубой, Тпл.= |
ReOCl4, корич.. |
ReOBr4, голубой |
|||
|
|
108, Ткип.=171 |
Тпл.=30, Ткип.=228 |
|
|||
|
|
|
|
|
|||
+5 |
|
ReOF3, темный |
MnOCl3, лет.жидкость |
|
|||
|
|
|
|
|
|
TcOCl3 |
TcOBr3 |
2KMnO4 + 14HCl → 2MnCl2 + 5Cl2 + 7H2O + 2KCl (K2MnCl6, KMnCl5•H2O)
KTcO4 + HCl → K2TcCl6 + Cl2 + H2O (H2TcCl6)
KReO4 + HCl → KReOCl5 + H2O
Литература.
1. Н.С.Ахметов, “Общая и неорганическая химия”, М., “Высшая школа”, 1988,
стр. 538-548.
2.Ф.Коттон, Дж.Уилкинсон, “Современная неорганическая химия”, М., “Мир”,
1969, ч.3, стр. 245-261, 389-409.
3.Б.В.Некрасов, “Основы общей химии”, М., “Химия”, 1974, т.2, стр. 296-310.
4.В.И.Спицын, Л.И.Мартыненко, “Неорганическая химия”, М., МГУ, 1994, ч.2,
стр. 202-233.
Дополнительная литература.
1.В.И.Спицын, А.Ф.Кузина, ”Технеций”, М., “Наука”, 1981.
