
Лекции 2, 19-20
.pdf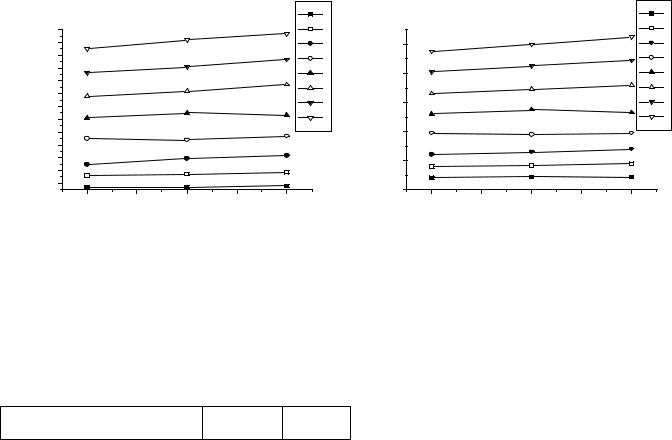
2Л19. Химия платиновых металлов.
|
|
|
Ru |
Os |
Rh |
Ir |
Pd |
Pt |
|
|
|
|
|
|
|
|
|
N пп |
|
|
44 |
76 |
45 |
77 |
46 |
78 |
|
|
|
|
|
|
|
||
эл.конф. |
4d75s1 |
4f145d66s2 |
4d85s1 |
5d76s2 |
4d105s0 |
5d96s1 |
||
ЭО |
|
|
2,2 |
2,2 |
2,2 |
2,2 |
2,2 |
2,2 |
|
|
|
|
|
|
|
|
|
rмет., пм |
|
134 |
135 |
134 |
135,5 |
137 |
138 |
|
|
|
|
|
|
|
|
|
|
Тпл., оС |
|
2282 |
3045 |
1960 |
2443 |
1552 |
1769 |
|
Ткип., оС |
|
4050 |
5025 |
3760 |
4550 |
2940 |
4170 |
|
∆Hпл.,кДж/моль |
25,5 |
31,7 |
21,6 |
26,4 |
17,6 |
19,7 |
||
|
|
|
|
|
|
|
||
∆Hат., кДж/моль |
640 |
791 |
556 |
669 |
377 |
545 |
||
|
|
|
|
|
|
|
|
|
d, г/см3 |
|
12,41 |
22,57 |
12,39 |
22,61 |
11,99 |
21,41 |
|
• |
см |
-1 |
6,71 |
8,12 |
4,33 |
4,71 |
9,93 |
9,85 |
ρ, ом |
|
|
|
|
|
|
|
|
структура |
ГПУ |
ГЦК |
ГЦК |
ГПУ |
ГЦК |
ГЦК |
||
|
|
|
|
|
|
|
||
Ru - Россия (лат.); Os - пахнущий (греч.); |
|
|
|
|||||
Rh - розовый; |
Ir - радужный; |
|
|
|
|
|||
Pd - богиня Паллада; Pt - “серебришко” (исп.). |
|
|
|
|||||
|
|
|
|
|
I1 |
|
|
13000 |
|
|
|
I2 |
|
|
12000 |
|
|
|
I3 |
10000 |
|
11000 |
|
|
|
||
|
|
|
|
I4 |
|
|
|
10000 |
|
|
|
|
|
|
|
|
|
I5 |
8000 |
|
|
9000 |
|
|
|
||
|
|
|
|
I6 |
|
|
|
8000 |
|
|
|
|
|
кДж/моль |
7000 |
|
|
|
I7 |
6000 |
6000 |
|
|
|
I8 |
|
|
5000 |
|
|
|
молькДжI, / |
4000 |
|
I, |
4000 |
|
|
|
|
|
|
|
|
|
|
|
|
|
3000 |
|
|
|
|
2000 |
|
2000 |
|
|
|
|
|
|
|
|
|
|
|
|
|
1000 |
|
|
|
|
0 |
|
44.0 |
44.5 |
45.0 |
45.5 |
46.0 |
|
|
|
|||||
|
|
|
N пп |
|
|
|
|
|
|
|
I1 |
|
|
|
|
I2 |
|
|
|
|
I3 |
|
|
|
|
I4 |
|
|
|
|
I5 |
|
|
|
|
I6 |
|
|
|
|
I7 |
|
|
|
|
I8 |
76.0 |
76.5 |
77.0 |
77.5 |
78.0 |
|
|
N пп |
|
|
Рис.1. Изменние потенциалов ионизаРис.2. Изменние потенциалов ионизации платиновых металлов 4d-ряда. ции платиновых металлов 5d-ряда.
Os + 2O2 → OsO4
RuO4 OsO4
Тпл., оС |
25 |
41 |
∆Hof, кДж/моль |
-239,3 |
-394 |
|
|
|
lЭ - О, пм |
|
174 |
Еион., в |
12,3 |
13,0 |
|
|
|
Ка (в воде) |
7•10-12 |
10-12 |
раст. в CCl4, г/100 г |
|
375 |
раств. в воде, г/100 г |
|
7 |
|
|
|
-nEo,в
10 |
Fe |
|
|
||
8 |
Ru |
|
Os |
||
|
||
6 |
|
4
2
0
-2
0 |
2 |
4 |
6 |
8 |
ст.окисления
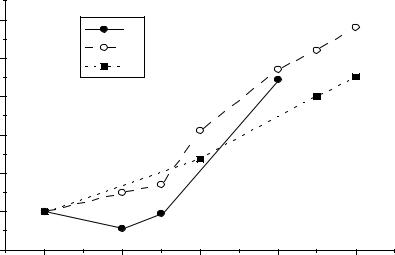
Рис.3. Диаграммы Фроста для элементов подгруппы железа (Fe, Ru, Os). Ru + Na2O2 → Na2RuO4
Na2RuO4 + Cl2 → RuO4 + NaCl ( в водном растворе) OsO4 + 2OH- → [OsO4(OH)2]2-
RuO4 + HClaq. → H3[RuCl6] + Cl2
8 |
|
|
|
|
|
|
|
Rh |
|
|
|
|
|
6 |
Ir |
|
|
|
|
|
Rh(Cl) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ir(Cl) |
|
|
|
|
|
4 |
|
|
|
|
|
|
,в |
|
|
|
|
|
|
o |
|
|
|
|
|
|
-nE |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
0 |
|
|
|
|
|
|
0 |
1 |
2 |
3 |
4 |
5 |
6 |
|
|
|
ст.окисления |
|
|
|
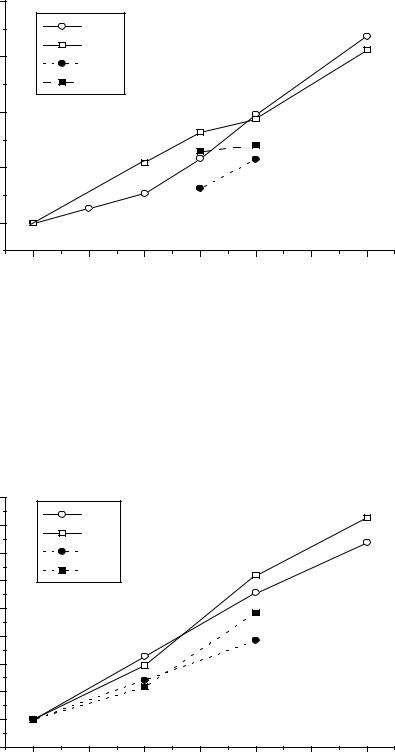
Рис.4. Диаграммы Фроста для Rh, Ir (pH=0). |
|
|
||||
2M + 3Cl2 → 2MCl3 |
(M= Rh, |
Ir) |
|
|
|||
∆Hof, кДж/моль |
|
|
242б7 |
280 |
|
|
|
|
8 |
Pt |
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
Pd |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
Pt (Cl) |
|
|
|
|
|
|
5 |
Pd(Cl) |
|
|
|
|
|
|
|
|
|
|
|
|
|
,в |
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
o |
3 |
|
|
|
|
|
|
-nE |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
-1 |
|
|
|
|
|
|
|
0 |
1 |
2 |
3 |
4 |
5 |
6 |
|
|
|
|
ст.окисления |
|
|
|
Рис.5. Диаграммы Фроста для Pt, Pd (pH=0)/ |
|
|
|||||
3Pt + 18HCl + 4HNO3 → 3H2[PdCl6] + 4NO + 8H2O 3Pd + 12HCl + 2HNO3 → 3H2[PdCl4] + 2NO + 4H2O
ЭХ62- + 2е ЭХ42- + 2Х- (Ео, в; рН=0)
Э |
X= ClO4- |
Cl- |
Br- |
I- |
Pd |
1,60 |
1,29 |
0,99 |
0,42 |
|
|
|
|
|
Pt |
1,10 |
0,74 |
0,64 |
0,39 |
|
|
|
|
|
2Л20. Комплексные соединения платиновых металлов. Ru, Os (II, III, IV)
II [Э(NH3)6]2+; Э2(RCOO)4
III[Э(NH3)6]3+; [ЭГ6]3+ [Ru(NH3)6]Cl3; K3RuCl6
IV |
[ЭCl6]2- |
|
K2RuCl6 |
|
K2OsCl6 |
|
Ru(C5H5)2 - рутеноцен (аналог ферроцена) |
|
VI |
Ru + Cl2 + HCl + H2O → H2[RuO2Cl4] |
|
|
|
H2[OsO2Cl4] |
|
|
Rh, Ir (II, III, IV). |
II |
Э2(RCOO)4; Э2(RCOO)4L2 Э = Rh, Ir. |
|
|
M2[Rh2(RCOO)4Г2] |
|
|
M4[Rh2(CO3)4] |
|
III |
[Э(NH3)6]X3; [ЭГ6]3- |
Э=Rh,Ir. |
|
KRh(SO4)2•12H2O) (оранжевый) |
|
|
M3[Ir(C2O4)3] |
(оранжевый) |
Pd, Pt (II, IV)
Pd + 4HNO3 → Pd(NO3)2 + 2NO2 + 2H2O (аналогично никелю) Pt + 6HCl + 2HNO3 → H2PtCl6 + 2NO + 4H2O
H2PtCl6•2H2O Þ (H3O)2[PtCl6] (красное кристаллическое вещество) (NO)2[PtCl6
[PtCl6]2- + Pt + 2Cl- → 2[PtCl4]2- (восстановители: SO2, альдегиды, ...)

Устойчивость галоогенидных комплексов М(II).
M |
MCl42- |
MBr42- |
MI42- |
Pd |
6•10-13 |
8•10-17 |
10-25 |
Pt |
3•10-17 |
4•10-21 |
3•10-30 |
|
|
|
|
И.И.Черняев 1926 г. Правило транс-влияния.
[PtCl4]2- + NH3 → [Pt(NH3)Cl3]- + NH3 → цис-[Pt(NH3)2Cl2] (желто-зеленый) [Pt(NH3)4]2+ +Cl- → [Pt(NH3)4Cl]+ + Cl- → транс-[Pt(NH3)2Cl2] (ярко-желтый)
|
Cl |
A |
Cl |
A |
|
+NH3 |
Pt |
|
Pt |
-Cl- |
|
B |
Cl |
B |
NH3 транс-влияние A>B. |
|
|
Ряд транс-влияния:
CN- > CO >PR3 > HSO3- > NO2- > I- > Br- > Cl- > py > RNH2 > NH3 >OH- > H2O
Статический эфффект транс-влияния.
Cl |
2,38 |
|
PMe3 |
|
|
Cl |
2,29 |
2,31 |
|
PEt3 |
|||||||
|
|
|
|
|
|
Pt |
|
|
|||||||||
|
|
|
Pt |
2,25 |
|
|
|
|
|
|
|
|
|
|
|
||
Cl |
|
|
PMe3 |
|
|
PEt3 |
|
|
Cl |
||||||||
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
2,38 |
|
Cl |
|
|
|
|
Cl |
2,02 |
NH(CH3)2 |
|||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
Cl |
|
|
|
|
|
|
|
|
Pt |
|
|
|||||
|
|
|
Pt |
|
2,30 |
|
|
|
|
|
|
CH2 |
2,32 |
||||
|
|
CH2 |
|
|
Cl |
|
|
|
|
|
|
|
Cl |
||||
1,37 |
|
|
|
|
|
1,47 |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
CH2 |
|
|
|
|
|
|
|
|
CH2 |
|
|
|
||||
Соль Цейзе - K[PtCl3(C2H4)] |
|
|
[PtCl2(NH3)(C2H4)] |
||||||||||||||
[PtLN2T] + E |
→(медл.) →[PtELN2T]→(быстро) → [PtEN2T] + L |
||||||||||||||||
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
T |
N |
|
|
|
|
L |
-L |
T |
N |
|
|
|||
|
|
|
|
E |
Pt E |
|
|
||||||||||
|
|
|
Pt L |
|
|
|
|
Pt |
|
|
|
||||||
N |
|
|
|
|
|
T |
|
|
|
|
E |
|
|
||||
|
|
|
|
|
N |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|||||||||
N
Катализ.
1) Гетерогенный (Pt, Pd, Rh, ...[Ni]) - процессы гидрирования - дегидрирования, риформинга.
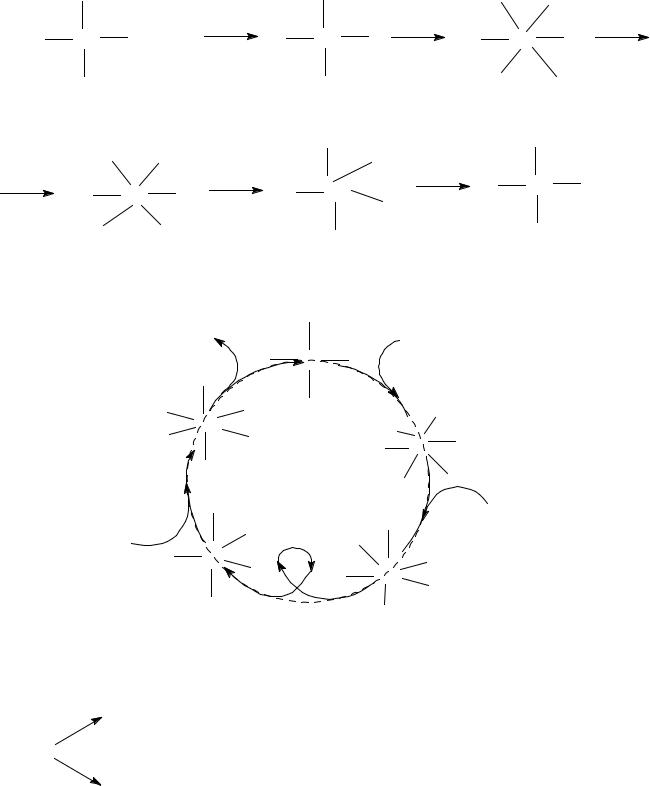
2) Гомогенный катализ ( комплексные соединения платиновых металлов). Катализатор Вилкинсона (G.Wilkinson).
[Rh(P Ph3)3Cl]
L |
|
|
|
|
|
|
S |
|
|
|
H |
H |
|
L Rh |
L + S |
|
|
L |
Rh |
|
H2 |
|
L |
Rh |
CH2=CH2 |
||
|
|
|
L |
|
L |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
-S |
Cl |
|
|
|
|
|
|
Cl |
|
|
|
Cl |
|
S |
H |
|
H |
|
|
|
|
H |
|
|
|
|
L |
|
|
|
|
|
|
|
|
L |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
L |
Rh |
L |
|
|
Cl |
Rh |
|
+S |
L |
Rh |
S + C2H6 |
||
|
|
|
L |
|
|||||||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
CH =CH |
|
|
|
CH2-CH3 |
|
|
Cl |
|
|||
|
|
2 |
|
|
|
|
|
|
|||||
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Петли Толмена. |
|
|
|
|
||||
|
|
|
CH3-CH3 |
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2 |
|
|
|
|
||
|
|
|
H |
L |
|
Rh |
L |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
L |
Rh |
S |
|
Cl |
|
H |
H |
|
|
|
|
|
|
Cl |
L |
|
|
|
L |
|
|
|
|||
|
|
|
|
|
|
|
L Rh |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
CH2-CH3 |
|
|
|
Cl |
S |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
H |
L |
|
|
|
H |
|
CH2=CH2 |
|
|
|
S |
|
|
|
|
|
L |
|
|
|
|
||
|
Cl |
|
Rh |
|
|
|
H |
|
|
|
|||
|
|
|
L |
|
Cl |
|
|
|
|
||||
|
|
|
|
|
|
|
Rh |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
CH2-CH3 |
|
|
|
S |
|
|
|
||
|
|
|
|
|
|
CH2=CH2 |
|
|
|
|
|||
Гидрирование, гидроформилирование. Синтез - газ (H2 + CO).
CH4 (CnH2n+2)
H2 + CO  R-OH (CH3OH)
R-OH (CH3OH)
R-COH
Получение платиновых металлов.
1. Обогащение (промывка - самородки; электролиз - шламы). 2. Вскрытие:
Pd, Pt -”царская водка”;
Ir, Rh -сплавление с NaHSO4;
Ru, Os - окисление; сплавление с Na2O2.
3. Разделение:
а) окислительно-восстановительные реакции комплексных соединений.
б) оосажждение координационных соединений. 4. Выплавка металлов.
Литература.
1. Н.С.Ахметов, “Общая и неорганическая химия”, М., “Высшая школа”, 1988,
стр. 548-584.
2.Ф.Коттон, Дж.Уилкинсон, “Современная неорганическая химия”, М., “Мир”,
1969, ч.3, стр. 410-476.
3.Б.В.Некрасов, “Основы общей химии”, М., “Химия”, 1974, т.2, стр.377-413.
4.В.И.Спицын, Л.И.Мартыненко, “Неорганическая химия”, М., МГУ, 1994, ч.2,
стр. 273-289.
Дополнительная литература.
1.“Синтез комплексных соединений металлов платиновой группы” (под ред.И.И.Черняева), М., “Наука”, 1964.
