
Лекции 2, 23
.pdf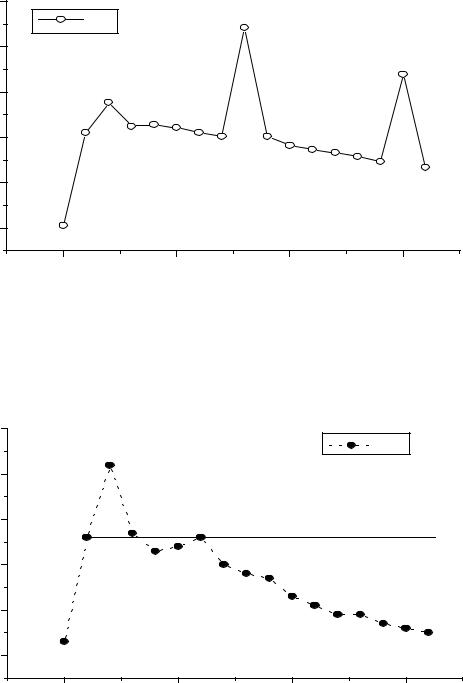
2Л23. Химия Sc, Y, La, Ln (РЗЭ).
эл-т |
Sc |
Y |
La |
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nпп |
21 |
39 |
57 |
58 |
59 |
60 |
61 |
62 |
63 |
64 |
65 |
66 |
67 |
68 |
69 |
70 |
71 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6s |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5d |
1 |
1 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4f |
- |
- |
- |
2 |
3 |
4 |
5 |
6 |
7 |
7 |
9 |
10 |
11 |
12 |
13 |
14 |
14 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
210 |
|
|
Eu |
|
|
|
|
rмет. |
|
|
|
|
|
|
|
|
|
200 |
|
|
|
Yb |
|
|
|
|
|
|
пм |
190 |
|
La |
|
|
|
|
|
|
|
|
мет., |
180 |
Y |
Ce |
|
|
|
|
|
|||
r |
|
|
|
|
|
|
170 |
|
|
|
|
|
160 |
Sc |
|
|
|
|
|
55 |
60 |
65 |
70 |
|
|
|
|
Nпп |
|
Рис.1. Изменение металлических радиусов РЗЭ (пм). |
|
||||
|
130 |
|
La |
|
r MIII |
|
|
|
|
||
|
120 |
|
|
|
|
|
110 |
Y |
|
|
|
,пм |
|
|
|
|
|
100 |
|
|
|
|
|
III |
|
|
|
|
|
rM |
|
|
|
|
|
|
90 |
|
|
|
|
|
80 |
Sc |
|
|
|
|
|
|
|
|
|
|
|
55 |
60 |
65 |
70 |
|
|
|
|
Nпп |
|

Рис.2. Изменение радиусов (пм) трехзарядных ионов РЗЭ. |
|||||
|
10 |
|
d |
|
|
|
|
|
Ce |
|
|
|
8 |
|
|
|
|
|
3 |
|
|
|
|
|
d,г/см 6 |
|
La |
|
Yb |
|
4 |
Y |
|
Eu |
|
|
|
|
|
|
|
|
2 |
Sc |
|
|
|
|
55 |
60 |
65 |
70 |
|
|
|
||||
|
|
|
|
N пп |
|
Рис.3. Изменение плотности для РЗЭ. |
|
||||
|
1800 |
|
|
Тпл. |
|
|
|
Sc |
|
|
|
|
1600 |
Y |
|
|
|
С |
1400 |
|
|
|
|
|
|
|
|
|
|
о |
|
|
|
|
|
, |
|
|
|
|
|
пл. |
|
|
|
|
|
Т |
1200 |
|
|
|
|
|
|
|
|
|
|
|
1000 |
|
|
|
|
|
|
|
La |
|
|
|
800 |
|
Ce |
Eu |
Yb |
|
|
|
|||
|
|
55 |
60 |
65 |
70 |
|
|
|
|
N пп |
|
Рис.4. Изменение температур плавления РЗМ.
|
|
Sc |
|
Eu |
E o,в |
|
|
-2.0 |
|
|
|
||
|
-2.1 |
|
|
|
|
|
,в |
|
|
|
|
Yb |
|
o |
-2.2 |
|
|
|
|
|
E |
|
|
|
|
||
|
-2.3 |
|
|
|
|
|
|
-2.4 |
Y |
|
|
|
|
|
|
|
|
|
|
|
|
|
55 |
60 |
65 |
70 |
|
|
|
|
|
N пп |
|
|
Рис.5. Изменение электродного потенциала M3+/M для РЗЭ. |
|
|||||
1000 |
|
|
Ce |
|
1000 › |
|
Š, %q |
|
›,ä*%“2ü |
|
|
|
|
|
|
|
|
Š, %q |
La |
|
|
n0j(I) |
|
|
|||
|
|
|
n0j(I) |
|
||
500 - c0j(II) |
|
|
|
|||
|
|
|
|
|||
|
|
3,71 |
n0Š(VI) |
|
500- |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
0 |
- |
cor(III) |
|
n0j(II) |
||
|
|
|
|
|
||
|
|
!%ìK,÷.(V) |
|
|
|
|
|
c0j |
|
|
cor(III) |
|
|
|
|
l |
l |
|
|
|
|
|
5 |
10P, ão= |
|
l |
l |
|
|
|
2 |
4 P, ão= |
||
|
|
|
|
|
||
1000 › |
|
|
Š, %q |
|
Pr |
500- cor(II) |
|
|
|
|
%!2%!.(IV) |
|
|
c0j(III) |
|
l |
l |
|
2 |
4 P, ão= |
› |
|
|
1000- |
n0j(I) |
|
Š, %q |
|
Sm |
|
|
|
500 - |
|
cor(III) |
|
|
|
|
|
äå-%!ì. |
2,C Sm (II)
|
l |
|
l |
|
2 |
|
4 P, ão= |
1500 ›,ä*%“2ü |
|
|
|
Š, %q |
n0j(I) |
|
|
|
|
||
1000- |
|
Gd |
|
|
|
|
|
|
cor(II) |
ãå*“=ã. cor |
|
500 - |
Sm(III) (IV) |
||
0 |
- |
|
|
|
-å!!%. |
|
|
|
l =…2,-lå!!%.l |
l |
|
|
|
4 P, ão= 8 |
|
1000 › |
|
|
|
||
Š, %q |
|
|
n0j(I) |
|
|
|
|
|
|
|
|
|
|
|
|
|
Nd |
500- |
|
|
|
c0j(III) |
|
|
|
|
|
|
|
|
|
cor(II) |
|
|
|
|
|
|
l |
|
l |
|
|
|
2 |
|
4 P, ão= |
|
›,ä*%“2ü |
|
|
||
1000- |
|
|
|
|
|
Š, %q |
|
n0j(I) |
|
Eu |
|
|
|
|
|||
500 - |
|
|
|
|
|
|
|
|
cor(II) |
|
|
0 |
- |
C=!=ì=ã…å2,* |
|
|
|
|
|
|
|
||
|
|
=…2,-å!!%ì=ã…å2,* |
l |
||
|
|
l |
l |
l |
|
|
|
|
8 P, ão= 12 |
||
1500 ›,ä*%“2ü |
|
|
|
|
Š, %q |
n0j(I) |
|
|
|
|
|
|
||
1000- |
|
|
|
Tb |
|
|
|
|
|
|
cor(II) |
|
||
500 - |
|
|
|
|
0 - |
|
|
2,C Sm(III) |
|
|
|
|
|
|
|
l |
l |
l |
l |
|
|
2 P, ão= 4 |
||

1500 ›,ä*%“2ü |
|
|
1500 ›,ä*%“2ü |
|
|
|
||
Š, %q |
n0j(I) |
Dy |
Š, %q |
n0j(I) |
|
Ho |
||
|
|
|
||||||
1000-cor(II) |
|
2,C Sm(III) |
1000-cor(II) |
|
|
|
||
|
|
|
|
|
|
|
||
500 - |
|
|
|
500 - |
|
|
2,C |
|
|
|
|
|
|
|
|
Sm(III) |
|
0 - |
|
|
|
0 - |
|
|
|
|
-å!!%ì=ã…å2,* |
|
|
=…2,-å!!%. |
|
|
|||
l |
l |
l |
l |
|
l |
l |
l |
l |
|
2 P, ão= 4 |
|
2 |
4 |
6 P, ão= |
|||
∆E, 103см-1
30
20
10
0 

-10
-20
-30
0 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
f n
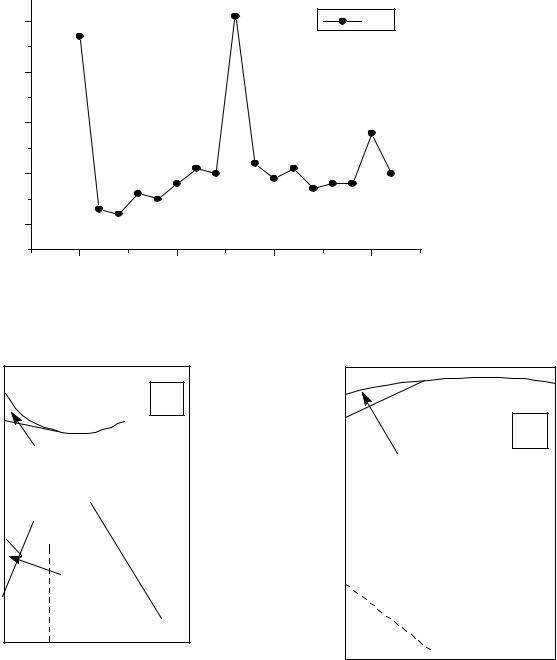
Рис.6. Энергетическая разность (∆E) электронных состояний fn-1d1s2 и fns2.
4
3
ст.ок.
+2

 +3
+3  +4
+4
La Pr |
Pm |
Eu |
Tb |
Ho Tm |
Lu |
Ce |
Nd |
Sm Gd |
Dy |
Er |
Yb |
2
56 |
58 |
60 |
62 |
64 |
66 |
68 |
70 |
72 |
|
|
|
|
N пп |
|
|
|
|
Рис.7. Проявляемые степени окисления РЗЭ.
а) |
|
|
|
|
|
б) |
|
|
|
|
|
|
|
|
Nd |
|
|
|
|
|
|
|
|
|
0 |
|
Dy |
|
Dy |
|
|
0 |
|
|
Sm |
|
|
|
|
|
|
|
|
|
|
Eu |
|
|
-2 |
|
|
|
Nd |
|
|
-2 |
|
|
Yb |
|
|
|
|
|
|
|
|
Tm |
|||
|
|
|
|
|
|
|
|
|
|
||
,в |
|
|
|
|
|
,в |
|
|
|
|
|
o |
-4 |
|
|
|
|
o |
|
-4 |
|
|
|
-nE |
|
|
|
|
-nE |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
-6 |
|
|
|
|
|
|
-6 |
|
|
|
|
-8 |
|
|
|
|
|
|
-8 |
|
|
|
|
0 |
1 |
2 |
3 |
4 |
|
|
0 |
1 |
2 |
3 |
|
|
|
ст.ок. |
|
|
|
|
|
ст.ок. |
|
|
в) |
|
|
|
|
|
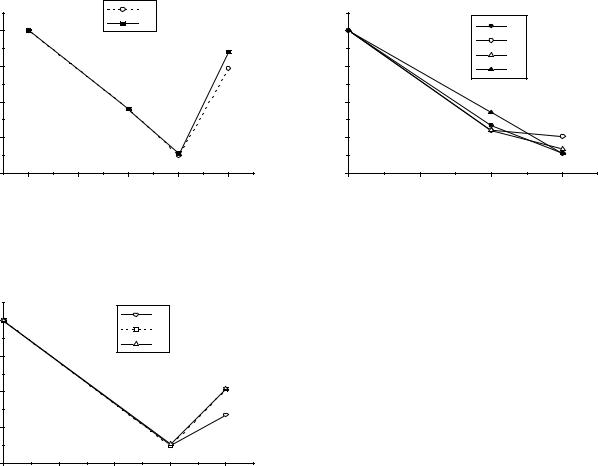
Рис.8. Диаграммы Фроста РЗЭ: |
|||||
|
|
|
|
|
|
а) |
Dy, Nd; |
|
|
||
|
|
|
Ce |
|
|
б) Sm, Eu, Yb, Tm; |
|
|
|||
|
0 |
|
|
|
в) Ce, Pr, Nd. |
|
|
||||
|
|
|
Pr |
|
|
|
|
||||
|
|
|
Tb |
|
|
|
|
||||
|
-2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
,в |
|
|
|
|
|
|
|
|
|
|
|
o |
-4 |
|
|
|
|
|
|
|
|
|
|
-nE |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-6 |
|
|
|
|
|
|
|
|
|
|
|
-8 |
|
|
|
|
|
|
|
|
|
|
|
0 |
1 |
2 |
3 |
4 |
|
|
|
|
|
|
|
|
|
ст.ок. |
|
|
|
|
|
|
|
|
|
|
|
Ce3+ |
+ 3OH- |
→ Ce(OH)3↓ (белый) |
|
|
||||
|
|
|
2Ce(OH)3 + H2O2 |
→ Ce(OH)4 |
(оранжевый) |
|
|
||||
|
|
|
Ce(OH)4 + 4HNO3 → Ce(NO3)4 + 2H2O |
|
|
||||||
2Ce(OH)4 + 8HCl → 2CeCl3 + Cl2 + 4H2O
( [CeCl6]2- ; (NMe4)2[CeCl6])
Ce3+/Ce4+aq. Eo = 1,74 в
Сравнительная характеристика комплексных соединений 3d-элементов и
|
РЗЭ3+. |
|
|
РЗЭ3+ |
3d-элементы |
ионный раддиус |
1,06 - 0,85 А |
0,75 - 0,6 А |
к.ч. |
6, 7, 8, 9 |
4, (5), 6 |
координационные |
триг. призма, квадр. ан- |
тетраэдр, квадрат, |
полиэдры |
типризма, додекаэдр |
октаэдр |
связи металл - лиганд |
слабое взаимодействие |
сильное |
|
4f-орбиталей металла с |
взаимоддействие |
|
орбиталями лигандов |
орбиталей (3d) металла |
|
|
с орбиталями лиганда |
сила связи |
F->OH->H2O>NO3->Cl- |
CN->NH3>H2O>OH->F- |
комплексы в растворе |
быстрый обмен |
медленный обмен лиган. |
|
лигандов |
|
|
Э3+ + 3OH- → Э(ОН)3↓ |
|
рПР Э(ОН)3 18,9 20,1 21,1 21,5 22,1 22,5 22,7 22,9 23,1 23,2 23,3 23,6 23,7
Э |
La Ce |
Pr |
Nd Sm Eu |
Gd |
Tb Dy Ho |
Tm |
Yb Lu |
∆Hof,(ккал/моль)Э(ОН)3 |
361 |
360 |
359 |
358 |
356 |
||
Э |
|
Pr |
Nd |
Sm |
Gd |
Dy |
|
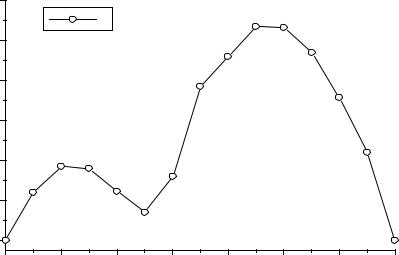
|
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
м.Б. |
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, |
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
0 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
|
|
|
|
|
n(fn) |
|
|
|
Рис.9. Значения магитных моментов для РЗЭ3+. |
|
|
|
|||||
Ион Э3+ |
Терм |
окраска |
Ион Э3+ |
Терм |
La |
1S0 |
бесцветная |
Lu |
1S0 |
Ce |
2F5/2 |
бесцветная |
Yb |
2F5/2 |
Pr |
3H4 |
зеленая |
Tm |
3H4 |
Nd |
4I9/2 |
красно-фиолетовая |
Er |
4I15/2 |
Pm |
5I4 |
розовая, желтая |
Ho |
5I8 |
Sm |
6H5/2 |
желтая |
Dy |
6H15/2 |
Eu |
7F0 |
бледно-розовая |
Tb |
7F6 |
Gd |
8S7/2 |
бесцветная |
Gd |
8S7/2 |
M2O3; |
CeO2 |
Tb4O7 (TbO1,71 - TbO1,81) TbO2 |
EuO; SmO |
|
Литература.
1. Н.С.Ахметов, “Общая и неорганическая химия”, М., “Высшая школа”, 1988,
стр. 499-502, 603-611.
2.Ф.Коттон, Дж.Уилкинсон, “Современная неорганическая химия”, М., “Мир”,
1969, ч.3, стр. 500-524.
3.Б.В.Некрасов, “Основы общей химии”, М., “Химия”, 1974, т.2, стр. 71-91.
4.В.И.Спицын, Л.И.Мартыненко, “Неорганическая химия”, М., МГУ, 1994, ч.2,
стр. 67-96.
Дополнительная литература.
1.”Координационная химия редкоземельных элементов” (под ред. В.И.Спицына, Л.И.Мартыненко), М., МГУ, 1979.
2.”Лантаноиды и актиноиды” (под ред. К.У.Бегналла), М., “Атоиздат”, 1977.
