
Лекции 2, 12
.pdf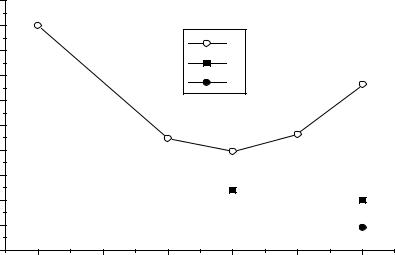
2Л12. Химия элементов V-Б группы.
|
V |
Nb |
Ta |
|
|
|
|
N пп |
23 |
41 |
73 |
|
|
|
|
элек. строение |
3d34s2 |
4d45s1 |
4f145d36s1 |
rM, пм |
132,1 |
142,9 |
143 |
rMV, пм |
59 |
69 |
64 |
rMIV , пм |
61 |
74 |
68 |
rMIII, пм |
65 |
- |
72 |
rMII, пм |
72 |
- |
- |
Тпл., оС |
1915 |
2468 |
2980 |
Ткип., оС |
3350 |
4758 |
5534 |
∆Hпл., кДж/моль |
17,5 |
26,8 |
24,7 |
|
|
|
|
∆Hисп., кДж/моль |
459,7 |
680,2 |
758,2 |
|
|
|
|
∆Hат., кДж/моль |
510(29) |
724 |
782(6) |
|
|
|
|
d(20o), г/см3 |
6,11 |
8,57 |
16,65 |
ρ(20о), µом•см-1 |
~25 |
12,5 |
~12,4 |
|
|
|
|
|
0.5 |
|
|
|
|
|
|
0.0 |
|
|
|
|
|
|
-0.5 |
|
|
V |
|
|
|
|
|
Nb |
|
|
|
|
-1.0 |
|
|
|
|
|
|
|
|
Ta |
|
|
|
|
-1.5 |
|
|
|
|
|
|
|
|
|
|
|
|
,в |
-2.0 |
|
|
|
|
|
o |
|
|
|
|
|
|
-nE |
-2.5 |
|
|
|
|
|
|
-3.0 |
|
|
|
|
|
|
-3.5 |
|
|
|
|
|
|
-4.0 |
|
|
|
|
|
|
-4.5 |
|
|
|
|
|
|
0 |
1 |
2 |
3 |
4 |
5 |
|
|
|
ст.окисления |
|
|
|
Рис.1. Даграмма Фроста для V, Nb, Ta. |
|
|
||||

-lgC |
- |
|
|
|
|
|
|
|
|
|
|
V10O286- |
|
|
|
VO43- + H+ HVO42- |
|
|
||||||||||
0 |
- |
V |
O |
4- |
|
|
|
|
|
|
|
|
|
2HVO4 V2O74- + H2O |
|
|||||||||||||
|
|
|
2 |
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
- |
|
|
|
|
|
|
|
n- |
|
|
|
|
|
V2O5 |
|
|
|
4- |
|
|
+ |
n- |
|||||
2 |
|
|
|
|
|
(VO3)n |
|
|
|
|
|
|
|
n/2V2O7 |
+nH |
|
(VO3)n |
+n/2H2O |
||||||||||
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HVO4 |
2- |
+ H |
+ |
H2VO4 |
- |
|||||||
3 |
|
- |
HVO 2- |
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|||||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
+ |
|
|
|
|||||||
4 |
-VO4 |
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
VO2 |
H2VO4 |
|
|
H3VO4 |
||||||||
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ H |
|
|||||||||
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
H |
VO |
- |
|
|
H3VO4 |
|
H VO |
4 |
|
+ H+ VO |
+ |
+ H O |
||||||||
|
|
|
|
|
|
|
|
|
2 |
|
4 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
2 |
2 |
||
|
| |
|
| |
| |
| |
| |
| |
| |
| |
| |
|
| |
| |
| |
| |
| |
| |
|
|
|
|
|
|
|
|
|
|
|
|
14 |
|
|
12 |
|
10 |
|
8 |
6 |
|
4 |
|
2 |
|
0 |
pH |
|
|
|
|
|
|
|
|
|
|
||
|
|
(VO3-)∞ |
V10O286- |
к.ч.=4, VO4 |
к.ч.=5 VO5 |
к.ч.=6 VO6 |
|
[VO2+2/2] ∞ |
[VO2+3/3] ∞ |
|
|
V2O5 |
к.ч.=5 |
[vO1+1/2+3/3] ∞ |
|
V2O5 = MOH → M3VO4 (pH > 13) |
|
||
|
MVO3 (pH < 13) |
|
|
V2O5 + 2H+ →2VO2+ (ph ~ 0) |
|
||
V2O5 |
+ 6HCl → 2VOCl2 + Cl2 + 3H2O |
|
|
V2O5 |
+ 3SOCl2 → 2VOCl3 + 3SO2 |
|
|
V2O5 |
+ H2SO4 + SO2 → 2VOSO4 + H2O |
|
|
Nb2O5(Ta2O5) + 3 Na2CO3 → 2Na3Nb(Ta)O4 + 3CO2
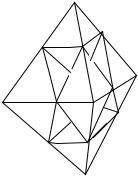
M6O198-
(M=Nb, Ta)
|
|
|
Галогениды V, Nb, Ta. |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
VF5 ,темн.,Тпл. =19,5 оС, |
|
NbF5, белый, Тпл. =79, |
TaF5, белый, Тпл. =97, |
||||||
Ткип. =48,3 |
|
|
Ткип. =234 |
|
Тпл. = 229 |
|
|
||
|
|
|
|
|
|
|
|
|
|
- |
|
|
NbCl5, золотистый, Тпл. = |
TaCl5, белый, Тпл. = 210, |
|||||
|
|
|
203, Ткип. = 247 |
|
Ткип. = 233 |
|
|
||
|
|
|
|
|
|
|
|
|
|
- |
|
|
NbBr5, оранжевый, Тпл. = |
TaBr5, желтый, Тпл. = |
|||||
|
|
|
254, Ткип. = 360 |
|
280, Ткип. = 345 |
||||
|
|
|
|
|
|
|
|
|
|
- |
|
|
- |
|
|
TaF5, черный, Тпл. = 496, |
|||
|
|
|
|
|
|
Ткип. = 543 |
|
|
|
|
|
|
|
|
|
|
|
|
|
VF4, зеленый, субл.>150 |
|
NbF4, черный, субл.>360 |
- |
|
|
|
|||
VCl4, корич.-красный,Тпл. |
NbCl4, черно- |
|
TaCl4, черный |
||||||
= -26, Ткип. = 148 |
|
фиолетовый |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
VBr4, темно-коричневый |
|
NbBr4, темно- |
|
TaBr4, черный |
|||||
|
|
|
коричневый |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
VF3, золотисто-зеленый, |
- |
|
|
- |
|
|
|
||
Тпл. = 800 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
VCl3, фиолетовый |
|
- |
|
|
- |
|
|
|
|
Сректральные характеристики V(II) - d3. |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||
Соединение |
ν1,см-1 |
ν2, см-1 |
ν3, см-1 |
10 Dq, см-1 |
B |
µ, м.Б. |
|
||
|
|
|
|
|
|
|
|
|
|
[V(H2O)6]SO4 |
12 100 |
18 000 |
28 000 |
12 100 |
|
650 |
3,85 |
|
|
K4[VCl6] |
7 200 |
12 000 |
19 000 |
7 200 |
|
800 |
3,72 |
|
|
[V(en)3]Br2 |
15 500 |
21 400 |
(32 000) |
15 500 |
|
581 |
3,75 |
|
|
K4[V(CN)6] |
22 300 |
27 700 |
(36 700) |
22 300 |
|
484 |
3,78 |
|
|
[V(NH3)6]Br2 |
14 800 |
21 200 |
(32 000) |
14 800 |
|
660 |
3,74 |
|
|
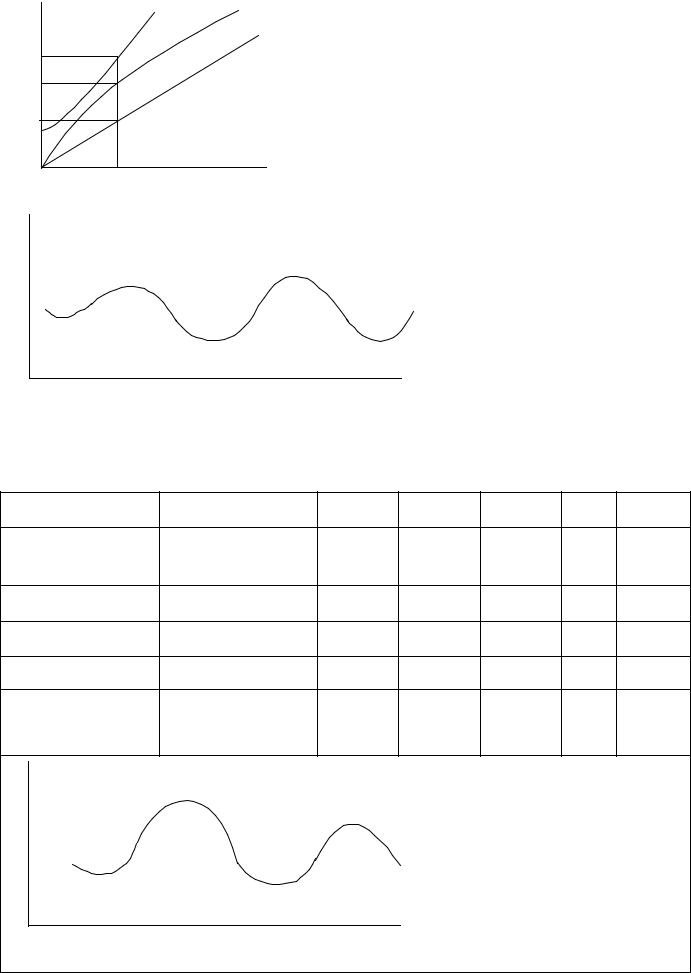
Рис.2. Диаграмма Оргела (d3, октаэдр). |
|
Переходы. |
||||||||
E/B - |
|
4T1g(P) |
4T1g(F) |
|
|
|
ν1 = 4A2g → 4T2g (=10 Dq) |
|||
50 - |
|
|
|
|
4T2g(F) |
|
|
ν2 = 4A2g → 4T1g |
||
- |
|
|
|
|
|
|
ν3 = 4A2g → 4T1g |
|||
30 - |
|
|
|
|
|
|
|
|
|
|
P - |
|
|
|
|
|
|
|
|
|
|
10 - |
|
10 Dq |
|
4A2g |
|
|
|
|
|
|
F |
| |
| |
| |
| |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
1 |
2 |
3 |
4 |
Dq/B |
|
|
|
|
||
|
|
|
|
|
||||||
D - |
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
0,5 - |
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
0,2 - |
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
0 - |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
|
||||||||||
|
30 |
28 |
26 |
24 |
22 |
20 |
18 |
16 |
14 |
ν.1000 “ì-1 |
Рис.3. Электронный спектр V(II) |
C =10-2 M в водном растворе. |
|
|
|||||||||
Спектральные характеристики V(III) - d2/ |
|
|
|
|
||||||||
Соединение |
|
окраска |
|
|
ν1,см-1 |
ν2,см-1 |
10 Dq |
B |
µ, м.Б |
|||
(NH4)V(SO4)2•12H2 голубая |
|
|
17 800 |
25 700 |
19 200 |
620 |
2,81 |
|||||
O |
|
|
|
|
|
|
|
|
|
|
|
|
VCl3•(CH3CN)3 |
|
зеленая |
|
|
14 400 |
21 400 |
15 500 |
540 |
2,79 |
|||
VCl3•(THF)3 |
|
оранжевая |
|
13 300 |
19 900 |
14 000 |
553 |
2,82 |
||||
K3VF6 |
|
|
зеленая |
|
|
14 800 |
23 250 |
16 100 |
649 |
2,78 |
||
(PyH)3VCl6 |
|
фиолетово- |
|
16 650 |
18 350 |
12 680 |
513 |
2,74 |
||||
|
|
|
розовый |
|
|
|
|
|
|
|
|
|
D - |
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
0,5 - |
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
0,2 - |
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
0 - |
|
|
|
|
|
|
|
|
|
|
|
|
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
|
|
|
30 |
28 |
26 |
24 |
22 |
20 |
18 |
16 |
14 |
ν.1000 “ì-1 |
|
|
|
Рис.4. Электронный спектр V(III) в водном растворе C=10-2 M. |
|
|
||||||||||
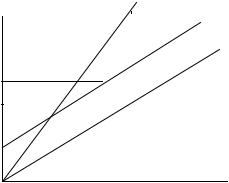
Рис.5. Диаграмма Оргела (d2, октаэдр) |
|
|
Спектральные переходы. |
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A2g(F) |
|
T1g(P) |
ν |
|
= 3T |
|
|
(F) → |
3T (F) |
|
|||||||||||||||||||
E/B - |
|
|
|
|
|
|
|
|
1 |
|
3 |
|
1g |
|
3 |
2g |
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ν2 = |
T1g(F) → |
T1g(P) |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
50 - |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T2g(F) |
ν3 = 3T1g(F) → A2g(F) |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
30 - |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
10 - |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T1g(F) |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
F |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
| |
|
| |
|
|
|
| |
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
1 |
2 |
|
|
3 |
|
4 Dq/B |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
Свойства оксогалогенидов. |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Степень |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F |
Cl |
|
|
|
|
|
|
|
Br |
I |
||||||||||
окисления |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
VOF3, золт., |
VOCl3, желт., |
|
VOBr3, темн. |
- |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Тпл.=300, |
Тпл.=-77, Ткип.= |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ткип.=480 |
127 |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
VO2F, кор. |
VO2Cl, оранж. |
|
- |
|
|
- |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NbO2F, белый |
NbOCl3, |
|
|
|
|
|
NbOBr3,зел.- |
NbOI3, черный |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
белый |
|
|
|
|
|
коричневый |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
TaOCl3, белый |
TaOBr3 |
NbO2I |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NbO2Cl, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
белый |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
TaO2Cl, белый |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
IV |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
VOF2, |
|
VOCl2,зелен. |
|
|
VOBr2,раз. |
- |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
зеленый |
|
|
|
|
|
|
186 |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NbOCl2,черн. |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
TaOCl2, темн. |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
III |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
VOCl,зел.-кор. |
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
Степень окисления +4. VO2+ к.ч. = 5 (6). |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
d1 VOSO4•5H2O |
к.ч.=6: 4 H2O; O (V=O); O (SO4) |
|
|||||||||||||||||||||||||||||||||||||||||||
|
|
|
VOC2O4•nH2O |
n=1, 4. |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
VO2+ + 2OH- → VO(OH)2↓
VO(OH)2 + 2OH- → [VO(OH)4]2- (?)
Литература.
1. Н.С.Ахметов, “Общая и неорганическая химия”, М., “Высшая школа”, 1988,
стр. 512-520.
2.Ф.Коттон, Дж.Уилкинсон, “Современная неорганическая химия”, М., “Мир”,
1969, ч.3, стр. 218-227, 343-355
3.Б.В.Некрасов, “Основы общей химии”, М., “Химия”, 1974, т.2, стр. 478-491.
4.В.И.Спицын, Л.И.Мартыненко, “Неорганическая химия”, М., МГУ, 1994, ч.2,
стр.116-145.
Дополнительная литература.
1.“Ниобий и тантал”, (под. ред.О.П.Колчина), М., “И.Л.”, 1960
