
Химия нефти
.pdfvk.com/club152685050 | vk.com/id446425943
ные органические соединения алкильные радикалы, то есть они являются алки-
лирующими реагентами. Высокая реакционная способность объясняется наличием сильнополярной связи С–Hal. Склонность галогенпроизводных к реакциям нуклеофильного замещения увеличивается в ряду F < Cl < Br < I.
I. Реакции замещения (SN).
1.Взаимодействие с солями галогеноводородных кислот в спирте или ацетоне. При замещении галогена с большой атомной массой галогеном с меньшей атомной массой следует применять соли серебра:
СН3СН2-Cl + NаI → СН3СН2-I + NaCl СН3СН2СН2-I + AgCl → СН3СН2СН2-Cl + AgI
2.Гидролиз галогенпроизводных УВ (ведут в присутствии едких щелочей или карбонатов щелочных металлов при нагревании, иногда выше температуры кипения воды):
СН3СН2-Cl + NaOH(водн.) → СН3СН2-OH + NaCl
3. Взаимодействие с алкоголятами простых эфиров: 2С2Н5Вr + NаОС2Н5 → С2Н5-О-С2Н5 + 2NаВr
диэтиловый эфир
4. Взаимодействие с аммиаком и аминами с образованием соответствующих первичных, вторичных и третичных аминов, а также солей аммониевых оснований.
СН3I + NH3 → (CH3NH3)+ I- → NH4I + CH3NH2
Иодистый метиламмоний метиламин
5. Взаимодействие с солями синильной кислоты: CH3Cl + NaCN→ CH3CN + NaCl
ацетонитрил
CH3CN + 2H2O → CH3COOH + NH3 (или СН3СООNН4)
6. Взаимодействие с солями органических кислот при нагревании:
С2Н5I + AgO-CO-CH3 → C2H5-O-CO-CH3 + AgI
ацетат серебра |
этилацетат |
7. Взаимодействие с нитритом серебра: C2H5I + AgNO2 → С2Н5NO2 + AgI
нитроэтан
8.Реакция Вюрца (см. получение алканов).
9.Каталитическое гидрирование галогеналкилов (Ni, Pt, Pb): СН3СН2Cl + Н2 → СН3СН3 + НCl
74
vk.com/club152685050 | vk.com/id446425943
II. Реакции отщепления (Е)
Взаимодействие со спиртовым раствором едких щелочей или органических соединений (хинолин, диметиланилин):
СН3СН2СН2Вr + КОН → СН3-СН = СН2 + КВr + Н2О
(спирт. р-р)
Получение галогенпроизводных УВ.
1. Галогенирование алканов (см. химические свойства алканов).
Хлор с алканами реагирует под действием УФ-излучения. Фтор с алканами реагирует очень энергично, даже со взрывом. Прямое бромирование для простейших алканов (метан, этан) малохарактерно. В принципе бромирование возможно при нагревании и интенсивном облучении УФ-светом.
2.Гидрогалогенирование и галогенирование алкенов и алкинов (см. химические свойства алкенов и алкинов). Присоединение галогенов к алкинам происходит медленнее, чем в случае алкенов. Механизм реакции присоединения галогенов к алкинам до конца не выяснен.
3.Галогенирование спиртов:
- фторирование SF4:
СН3СН2-ОН + SF4 → 2CН3СН2F + SO2 + 2HF
- действием галогеноводородов:
СН3СН2-ОН + НСl СН3СН2-Сl + Н2О
СН3СН2-ОН + КСl + Н2SО4 → СН3СН2-ОН Cl + КНSО4 + Н2О
- действием галогенидов фосфора:
СН3СН2СН2СН2-ОН + РСl5 → СН3СН2СН2СН2-Сl + НСl + РОСl3
- действием хлористого тионила:
СН3СН2СН2СН2-ОН + SОСl2 → СН3СН2СН2СН2-Сl + SО2 + НСl
При использовании галогенидов фосфора или хлористого тионила, реакция становится необратимой.
4. Получение галогенпроизводных из альдегидов и кетонов.
Эта реакция осуществляется при действии РCl5, PBr5, SF4 при нагревании:
СН3СОН + РСl5 → С2Н4Сl2 + POCl3
СН3СОСН3 + SF4 → CH3CF2 СН3 + O=SF2
Ацетон (пропанон)
5. Фтористые алкилы получают обменной реакцией из хлористых, бромистых или иодистых алкилов действием фторидов Hg, Ag, Co, Sb и др.:
2С2Н5Вr + НgF2 → 2C2H5F + HgBr2
75
vk.com/club152685050 | vk.com/id446425943
3.9.3 Асфальтосмолистые вещества (АСВ)
АСВ состоят из различающихся молекулярной массой асфальтенов и смол и являются гетероатомными высокомолекулярными системами. Они рас-
пространены в нефтях, природных битумах, высококипящих фракциях процессов нефтепереработки. Содержание АСВ в нефтях составляет 1–40 %.
Высококипящие нефтяные фракции (асфальты, гудроны, крекинг-остатки) являются концентратами АСВ. Асфальтены осаждаются из бензольных и толу-
ольных растворов нефтей и нефтяных остатков избытком жидких алифатических углеводородов (способ Гольде). Смолы отделяются от масел мальтеновой части на силикагеле с последующей экстракцией бензолом и спиртобензольной смесью.
Смолисто-асфальтеновые вещества представляют собой сложную смесь высокомолекулярных соединений смешанных структур, содержащих азот, серу,
кислород, металлы. Их много в тяжёлых нефтях Казахстана, Средней Азии, Башкирии. Их летучесть невелика, в бензиновый и керосиновый дистилляты они не попадают. Наиболее богаты смолисто-асфальтеновыми веществами молодые нефти ароматического основания.
Смолисто-асфальтеновые вещества объединяют две большие группы высокомолекулярных соединений нефти – смолы и асфальтены, в химическом составе, строении и свойствах которых имеется много общего. Соотношение между смолами и асфальтенами в нефтях и тяжёлых остатках, где в основном они концентрируются, составляет от 9 : 1 до 7 : 1.
Физико-химические свойства смол: среднечисловая молекулярная масса смол, определённая криоскопией в нафталине, колеблется от 600 до 800 ед. По данным ЭПР смолы отличаются парамагнетизмом (концентрацией стабильных свободных радикалов) до 1018–1019спин/г и повышенной склонностью к ассоциации, что свидетельствует о наличии в структуре полиароматических свободно-
радикальных фрагментов, отношение С/Н составляет 0,60–0,83. По данным ИК, ПНР и ЯМР 13С смолы состоят из полициклических нафтеноароматических гете-
роатомных и карбоциклических структур, включающих цепочки алкильных заместителей и О-, S-содержащие функциональные группы. Асфальтены отличаются от смол повышенными: молекулярной массой до нескольких тысяч, степенью конденсации нафтеноароматических ядер, содержанием серы и вана-
дия, парамагнетизмом до 1021 спин/г. Существование свободных радикалов и замещённых нафтеноароматических структур обусловливает высокую реакционную способность АСВ в процессах дегидрополиконденсации, сульфи-
76
vk.com/club152685050 | vk.com/id446425943
рования, галогенирования, хлорметилирования, гидрирования и в процессах их конденсации с формальдегидом, непредельными смолами, малеиновым ангидридом и т. д. Продукты химических превращений АСВ могут быть использованы как модификаторы битумов и сырьё для производства эффективных сорбентов, ПАВ и электроизоляционных материалов. Кроме того, возможно применение АСВ для производства пеков, ингибиторов радикальных процессов окислительной деструкции полимеров, ингибиторов коррозии и т. д. В связи с проблемой рационального использования АСВ, определённую перспективу приобретает направление – получение концентратов АСВ путём глубокой деасфальтизации нефтяных остатков бензином (Добен-процесс). Продукты Добен-процесса могут быть использованы как стабилизаторы полимеров, сырьё для углеродистых и композиционных материалов и т. д.
Смолы. Состав и свойства нефтяных смол зависят от химической природы нефти. Несмотря на различную природу нефтей различных месторождений, содержание углерода и водорода в смолах колеблется в сравнительно узких преде-
лах (в % масс.): С – от 79 до 87; Н – от 9 до 11. В смолах нефтей различных месторождений содержание кислорода колеблется от 1 до 7 % (масс.), серы – от десятых долей процента до 7–10 %. В некоторых смолах содержится азот (до 2 %).
Смолы составляют от 70 до 90 % всех гетероорганических соединений нефти. Они богаче водородом, чем асфальтены, на 1–2 %. Большую часть смол составляют нейтральные вещества. Небольшое количество смол имеет кислый характер и образует асфальтогеновые кислоты. Они представляют собой вязкие, тёмные смолы, растворимые в спирте, бензоле, хлороформе.
Нейтральные смолистые вещества подразделяют по отношению к различным растворителям. На схеме представлена классификация и разделение смолисто-асфальтеновых веществ.
Смолы представляют собой очень вязкие малоподвижные жидкости, а
иногда и твёрдые аморфные вещества от тёмно-коричневого до бурого цвета. Плотность их близка к 1,1 г/мл, молекулярная масса от 600 до 1000.
Смолистые вещества термически и химически нестабильны, легко окисляются и конденсируются, превращаясь при этом в асфальтены.
Смолы легко сульфируются, переходя в раствор серной кислоты. На этом основан серно-кислотный способ очистки топлив и масел. Смолистые вещества образуют комплексы с хлоридами металлов, фосфорной кислотой.
Попытки создать их «среднюю» молекулу привели к следующим структурам:
77
vk.com/club152685050 | vk.com/id446425943
Асфальтены |
Смолы |
Асфальтены являются более высокомолекулярными соединениями, чем смолы. Они отличаются от смол несколько меньшим содержанием водорода и более высоким содержанием гетероатомов. Считают, что асфальтены являются продуктами конденсации смол. Асфальтены образованы циклическими, полиядерными конденсированными структурами, похожими на графит.
Асфальтены – порошкообразные вещества бурого или чёрного цвета. При нагревании они размягчаются, но не плавятся. При нагревании выше 300°С
асфальтены превращаются в кокс и газы. Асфальтены химически активны. Они окисляются, сульфируются, галогенируются, нитруются, вступают в конденса-
цию с формальдегидом. При хранении на свету и при доступе воздуха они переходят в карбены, теряя растворимость.
Асфальтены подвергают окислению до кислот, превращают в кокс и гудрон. Используют для гидрофобизации различных поверхностей. Смолы и ас-
фальтены идут на переработку в более лёгкие традиционные нефтепродукты путём гидрокрекинга. Однако они сами тоже находят применение в качестве антисептиков, ингибиторов биоразрушения (пропитка шпал) и др.
Неорганические компоненты нефти
В нефтях встречаются соли и комплексы более 40 металлов и некоторых неметаллов. Минеральные компоненты принято разделять на три группы.
1-я группа: металлы переменной валентности – V, Ni, Fe, Mo, Co, W, Cr, Cu, Mn, Zn, Ti, Pb, Ag и др.
2-я группа: щелочные и щелочноземельные металлы– Na, K, Ba, Ca, Sr, Mg. 3-я группа: галогены и другие элементы – Cl, Br, I, Si, Al, Ge и др.
Небольшие количества минеральных составляющих создают трудности их определения. В заметных количествах обнаруживаются ванадий и никель,
причём ванадия больше в сернистых, а никеля – в азотистых частях нефтей.
78

vk.com/club152685050 | vk.com/id446425943
Чаще всего металлы находятся в виде порфириновых комплексов – реликтов органического происхождения (хлорофилл, гемоглобин).
Металлов в нефтях немного, но большинство из них каталитически ак-
тивны (часто ингибиторы), поэтому их состав и содержание необходимо контролировать во избежание проблем при очистке и переработке, особенно термокаталитической. К тому же высшие оксиды некоторых металлов (ванадий, хром, вольфрам) являются окислителями, имеют кислотный характер и усили-
вают коррозию металлов.
3.9.4 Серосодержащие соединения нефти
Сера является наиболее распространённым гетероэлементом в нефтях и нефтепродуктах. Интерес к серосодержащим соединениям нефти возрос в связи с проблемой переработки высокосернистых нефтей. В пластовых нефтях содержится от 0,01 до 14 % масс. серы.
В настоящее время найдено около 190 разных серных соединений, присутствующих в западносибирской нефти. Содержание серы в основном отмече-
но в виде гомологов и циклических сульфитных соединений, а также сульфидов и дисульфидов. При этом надо понимать, что сера – это самый
«грязный и вредный» элемент нефти, образующий в результате переработки нефтяной кокс.
В лабораторных условиях органические соединения серы могут быть выделены из нефти экстракцией ацетонитрилом или другими растворителями.
Кроме того, в нефти может присутствовать свободная (элементарная) сера и сероводород. Суммарное содержание серы в нефтях находится в пределах
0,1–7,5 % (до 0,5 % – малосернистые, до 1 % – сернистые, выше 1 % – высокосернистые). Сераорганические соединения главным образом представлены меркаптанами (тиолы), общая формула CnH2n+1SH (n = 2,3,4….), сульфидами (CnH2n+1)2S, дисульфидами (CnH2n+1)2S2 и гетероциклическими соединениями,
среди которых наиболее важными являются тиофены и тиофаны (гидрированные тиофены) – С4Н8S:
Сернистые соединения, присутствующие в нефти и газолине, полученном либо из нефти перегонкой, либо адсорбцией из природного газа, являются нежелательными. К их числу относятся сероводород H2S, сероуглерод CS2, мер-
79
vk.com/club152685050 | vk.com/id446425943
каптаны с общей формулой RSH, тиоэфиры RSR, тиофены и др. Эти соедине-
ния вызывают коррозию аппаратуры (H2S и RSH в присутствии свободной серы), имеют неприятный запах (RSH), вызывают потемнение бензина, снижают действие добавок для повышения октанового числа, например тетраэтилсвинца. Из этих соображений становится обязательным удаление сернистых соедине-
ний, в первую очередь H2S и RSH. Процесс удаления довольно дорог, но во многих случаях оправдывает себя.
До настоящего времени, за исключением низкомолекулярных соединений, большая часть сернистых веществ нефтей не расшифрована. Свободная сера встречается в нефтях редко. Появление свободной серы связывают с разложением более сложных сернистых соединений.
Химические свойства сероорганических соединений, в основном тех,
что содержат S(II), напоминают свойства кислородсодержащих органических соединений.
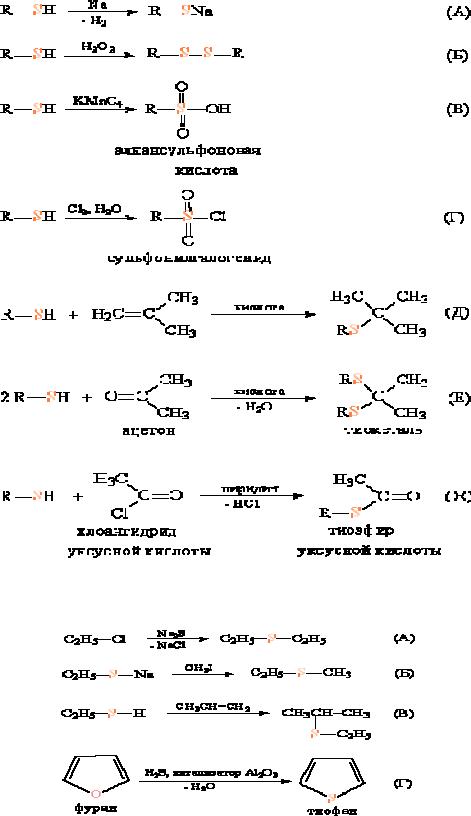
Тиолы – слабые кислоты и, подобно спиртам, могут реагировать с актив-
ными металлами, образуя тиоляты (рис. 2А). При действии мягких окислителей, например, пероксида водорода, они образуют дисульфиды (аналоги пероксидов) (рис. 2Б). Более сильные окислители (перманганаты) переводят их в алкилсульфоновые кислоты, в которых степень окисления серы VI (рис. 2В).
В присутствии каталитических количеств кислоты тиолы присоединяются к олефинам по двойной связи (рис. 2Г). При взаимодействии тиолов с альдегида-
ми или кетонами (катализатор – кислота) образуются тиоацетали или тиокетали (рис. 2Д) – аналоги соответствующих кислородных соединений. Подобно спир-
там, тиолы реагируют с хлорангидридами карбоновых кислот (в присутствии оснований, связывающих образующийся HCl), образуя тиоэфиры карбоновых кислот (рис. 2Ж), близкие к органическим сложным эфирам.
Тиоэфиры получают взаимодействием галогеналкилов с неорганическими сульфидами (рис. 3А). Когда нужно получить тиоэфиры с различающимися органическими группами, проводят взаимодействие галогеналкилов с тиолятами щелочных металлов (рис. 3Б), либо присоединением тиолов к олефинам (рис. 3В). В некоторых простых эфирах, имеющих циклическое строение, можно заменить атом О атомом S, при этом образуется циклический тиоэфир, например, тиофен, который относят кгетероциклическим соединениям(рис. 3Г).
80
vk.com/club152685050 | vk.com/id446425943
Рисунок 2 – Химические свойства тиолов
Рисунок 3 – Способы получения тиоэфиров
81
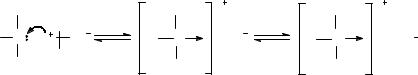
vk.com/club152685050 | vk.com/id446425943
3.9.5 Азотсодержащие производные УВ
Такие соединения равномерно распределены по нефтяным фракциям и различаются подразделением на следующие основные группы: нейтральные соединения и основные азотистые соединения. На самом деле такие соединения являются самыми «безобидными» с химической точки зрения и не оказывают особого влияния на сезонные и эксплуатационные свойства нефтей.
3.9.5.1 Амины. Анилин
Амины – органические соединения, которые можно рассматривать как производные аммиака (NH3), в молекуле которого один или несколько атомов водорода замещены углеводородными радикалами.
Гомологический ряд предельных аминов: СН3NH2 – метиламин (пер-
вичный амин), (СН3)2NH – диметиламин (вторичный амин), (СН3)3N – триметиламин (третичный амин) и т. д.
Изомерия: 1) углеродного скелета; 2) положения аминогруппы (NH2); 3) оптическая.
Физические свойства. Простейшие алифатические амины при нормальных условиях представляют собой газы или жидкости с низкой температурой кипения, обладающие резким запахом, характерным для аммиака. Они хорошо растворяются в воде. Амины являются полярными соединениями, для них характерно образование водородных связей, поэтому амины кипят при более высоких температурах, чем соответствующие алканы.
Химические свойства.
Будучи производными аммиака, для аминов характерны его химические свойства.
1. Взаимодействие с водой – образование гидроксидов замещённого аммония:
H |
|
H |
|
H |
|
|
CH3 N + H |
OH |
CH3 N |
H OH |
CH3 N |
H |
+ OH |
H |
|
H |
|
H |
|
|
|
метиламин |
гидроксид метиламмония |
ион метиламмония |
|||
Растворимые амины – более сильные основания, чем аммиак. Основные свойства у третичных аминов проявляются сильнее, чем у вторичных и первичных аминов.
2. Взаимодействие с кислотами – образование солей: CH3NH2 + НС1 = [CH3NH3]C1 
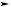 [CH3NH3]+ + Сl-
[CH3NH3]+ + Сl-
хлорид метиламмония
82

vk.com/club152685050 | vk.com/id446425943
Щёлочи, как более сильные основания, вытесняют амины из их солей:
[CH3NH3]C1 + NaOH = CH3NH2↑ + NaCl + H2O
3. Горение аминов.
4CH NH + 9O |
to |
4CO + 10H O + 2N |
||||
|
||||||
3 |
2 |
2 |
2 |
2 |
2 |
|
4. Первичные и вторичные амины реагируют с азотистой кислотой (пер-
вичные амины превращаются в спирты, вторичные – в N-нитрозамины): RNH2 + HNO2 → ROH + N2↑ + H2O,
R2NH + HNO2 → R2N–NO + H2O.
Получение аминов
1.Взаимодействие спиртов с аммиаком при нагревании в присутствии А12O3 в качестве катализатора:
R–OH + NH3 → R – NH2 + H2O.
2.Взаимодействие алкилгалогенидов (галогеналканов) с аммиаком,
например:
CH3Br + 2NH3 → CH3NH2 + NH4Br
При избытке алкилгалогенида и аммиака: CH3NH2 + СН3Вr + NH3 → (CH3)2NH + NH4Br
диметиламин
Анилин – важнейший представитель ароматических аминов: С6Н5NH2 Аминобензол (как производное бензола), фениламин (как производное аммиака)
Физические свойства. Анилин – бесцветная маслянистая жидкость с характерным запахом, малорастворим в воде, ядовит.
Химические свойства. Основные свойства у анилина выражены очень слабо, так как сказывается влияние бензольного ядра на аминогруппу.
Неподелённая электронная пара атома азота притягивается π-электронной системой ядра (эффект сопряжения), поэтому электронная плотность на атоме азота уменьшается.
H
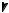 N
N 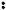



 H
H
Основные свойства у анилина выражены слабее, чем у алифатических аминов.
83
