
Химия нефти
.pdf
vk.com/club152685050 | vk.com/id446425943
Pt, Pd |
+ 3H2 |
o |
|
300 C |
|
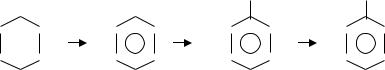
- дегидроциклизация (ароматизация) гексана (Н. Д. Зелинский, Б. А. Казанский, А. Ф. Платэ):
CH |
3 |
|
CH |
2 |
|
CH2 |
|
CH2 |
|
CH2 |
|
CH3 |
300oC |
|
|
|
+ 4H2 |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
Pt |
|
|
|
|||||||||
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- тримеризация ацетилена и его гомологов:
3HC |
CH 500oC |
|
C |
|
2. В лаборатории: |
- сплавление солей бензойной кислоты с щелочами:
O |
|
|
C |
Na |
|
|
+ |
NaOH |
to
+ Na2CO3
- реакция Вюрца–Фиттига:
|
CH3 |
Cl |
|
+ 2Na + Cl CH3 to |
+ 2NaCl |
- алкилирование по Фриделю–Крафтсу (см. химические свойства аренов).
Задача5. Составьте уравнения реакций, описывающие схему превращений:
|
NaOH |
|
1500°С |
t, С |
Н |
|
ацетат натрия Х |
Х |
акт С |
||||
|
сплав. |
1 |
2 |
6 |
6 |
|
CH Cl, AlCl |
HNO3(изб.) , H2SO4 , t |
|
|
|
||
3 3 X3 |
X4 |
|
|
|
||
Решение.
сплавление
1) CH3COONa + NaOH Na2CO3+ CH4 - X1 - метан
15000C
2) 2CH4 3H2 + C2H2 - X 2- ацетилен
t,C
3) 3С2H2 акт C6 H6
AlCl
4) C6H6 + CH3Cl 3 C6H5-CH3 - X3 - метилбензол, толуол 5) С6H5-CH3 + 3HO-NO2 H2SO4 3H2O + H3C-C6H2-(NO2)3 -X4
2,4,6-тринитротолуол
54
vk.com/club152685050 | vk.com/id446425943
Задания к разделу «Арены»
141.Составьте структурные формулы изомеров, отвечающих формуле С8Н10 и содержащих ароматическое кольцо.
142.Сколько изомерных гомологов бензола может отвечать формуле С9Н12? Напишите структурные формулы изомеров и назовите их.
143.Напишите уравнения реакций, которые надо провести для осуществ-
ления следующих превращений:
СН3 СООН
Укажите условия протекания реакций.
144.Какой объём воздуха, измеренный при нормальных условиях, потребуется для полного сгорания 1,4-диметилбензола массой 5,3 г ? Объёмная доля кислорода в воздухе составляет 21 %.
145.При сжигании гомолога бензола массой 0,92 г в кислороде получили оксид углерода (IV), который пропустили через избыток раствора гидроксида кальция. При этом образовался осадок массой 7 г. Определите формулу углеводорода и назовите его.
146.Ароматический углеводород, являющийся гомологом бензола, массой 5,3 г сожгли, получив оксид углерода (IV) объёмом 8,96 л (н.у.). Определите формулу углеводорода. Сколько изомеров может иметь этот углеводород среди гомологов бензола? Напишите структурные формулы этих изомеров.
147.Из ацетилена объёмом 3,36 л (н.у.) получили бензол объёмом 2,5 мл. Определите выход продукта, если плотность бензола равна 0,88 г/мл.
148.При бромировании бензола в присутствии бромида железа (III) получили бромоводород, который пропустили через избыток раствора нитрата серебра. При этом образовался осадок массой 7,52 г. Вычислите массу полученного продукта бромирования бензола и назовите этот продукт.
149.Бензол, полученный дегидрированием циклогексана объёмом 151 мл
иплотностью 0,779 г/мл, подвергли хлорированию при освещении. Образовалось хлорпроизводное массой 300 г. Определите выход продукта реакции.
150.Приведите уравнения реакции необходимых для превращений:
а) гексан → бензол → циклогексан; б) ацетилен → бензол → гексахлорциклогексан.
151. Приведите не менее трёх химических реакций, в результате которых может быть получен толуол. Укажите необходимые условия протекания реакций.
55
vk.com/club152685050 | vk.com/id446425943
152.В лаборатории из 25 л ацетилена было получено 16 г бензола. Сколько это составляет (в %) от той массы, которая должна была образоваться согласно уравнению реакции?
153.Составьте формулы бромзамещённых толуола, в которых массовая доля брома составляет 46,72 %.
154.Сколько может существовать изомерных триметилбензолов и тетраметилбензолов? Составьте их формулы строения и укажите, какие из этих соединений можно назвать симметричными.
155.Чем отличается по типу реакция брома с бензолом от реакции его с этиленом? Ответ подтвердите, приведя уравнения реакций.
156.Действием брома на 78 г бензола было получено столько же граммов бромбензола. Сколько это составляет (в %) от той массы, которая должна образоваться, если весь взятый бензол вступил бы в реакцию?
157.К смеси изомерных бутенов-2 и бензола добавили бромной воды до появления слабой окраски и после отмывки избытка брома раствором щёлочи смесь высушили и перегнали. Какое вещество было получено в приёмнике?
158.При сжигании 1,3 г вещества образуется 4,4 г углекислого газа и 0,9 г воды. Плотность паров этого соединения по водороду равна 39. Выведите молекулярную формулу этого вещества.
159.Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
а) СН4 |
→ С2Н2 → С6Н6 → С6Н5Сl |
бутен |
б) СаСО3 → СаС2 → С2Н2 → С2Н4 → С2Н5Сl |
||
|
|
циклобутан |
|
|
циклогексан |
в) СН4 |
→ С2Н6 → С3Н8 → С6Н14 |
|
|
|
С6Н6 → С6Н5NO2 |
160. Согласно схеме генетической связи ароматических углеводородов с другими классами органических соединений, приведите соответствующие
уравнения реакций: |
|
|
предельные |
|
галогенопроизводные |
углеводороды |
|
бензола |
ацетилен |
бензол |
нитробензол |
|
циклопарафины |
|
56
vk.com/club152685050 | vk.com/id446425943
3.9 Гетероатомные соединения нефти
К гетероатомным компонентам нефти относятся сернистые, кислородсодержащие, азотсодержащие и высокомолекулярные (асфальтосмолистые) соединения, содержание которых колеблется от 5 до 20 % масс. До 70–90 % гетероатомных компонентов: сернистых в виде меркаптанов (тиолов), сульфидов, тиофенов и тиофанов, а также полициклических концентрируется в остаточных продуктах – мазуте и гудроне; азотсодержащие в виде гомологов пиридина, хинолина, индола, карбазола, пиррола, а также порфирины концентрируются в тяжёлых фракциях и остатках; кислородсодержащие нафтеновые кислоты, фенолы, смолисто-асфальтеновые вещества сосредоточены обычно в высококипящих фракциях. Элементный состав (%): С 82–87; Н 11–14,5; S 0,01–8; N 0,001–1,8; О 0,005–1,2. С ростом температуры кипения нефтяных фракций и средней температуры кипения нефтей количество гетероатомных соединений увеличивается. Современная наука предполагает, что подобные соединения есть промежуточное звено на этапах превращения нефтей и их продуктов в эволюционном процессе.
3.9.1 Кислородсодержащие производные УВ
В подавляющем большинстве случаев содержание кислорода отмечено в фенолах нефтей и смолистых нефтяных месторождениях. А также в алифатических и нафтеновых кислотах по всей территории Западной Сибири, где и происходит массовая добыча исходного продукта. В свою очередь, функциональные группы нефтей по содержанию кислорода представляются в следующей последовательности: спирты, сложные и простые эфиры, смолистые и смо- листо-асфальтеновые кислоты и вещества.
3.9.1.1 Спирты
Спирты (алкоголи) – это производные углеводородов, содержащие в молекуле одну или несколько гидроксильных групп – ОН у насыщенных атомов углерода. Структура, содержащая ОН-группу у ненасыщенного атома углерода С= С–ОН (енолы), является неустойчивой. В зависимости от числа ОНгрупп выделяют одноатомные и многоатомные спирты.
Предельные одноатомные спирты (алканолы). Их основные характеристики: 1) общая формула СnН2n+1ОН, n > 1; 2) атомы углерода и кислорода находятся в состоянии sp3-гибридизации; 3) в молекуле спирта имеются две полярные связи С–О и О–Н: Сδ+–Оδ-–Нδ+, для них характерен гетеролитический разрыв связи.
57

vk.com/club152685050 | vk.com/id446425943
Гомологический ряд: СН3ОН – метанол, СН3СН2ОН – этанол,
СН3СН2СН2ОН – пропанол (первичный спирт), СН3СН(ОН)СН3 – изопропанол
(вторичный спирт) и т. д.
Изомерия: 1) углеродного скелета; 2) положения ОН-группы; 3) меж-
классовая (изомерны простым эфирам); 4) оптическая.
Физические свойства. Температуры кипения спиртов больше темпера-
туры кипения соответствующих алканов с тем же числом атомов углерода. Это объясняется ассоциацией молекул спиртов вследствие образования межмолеку-
лярных водородных связей.
Прочность ВС значительно меньше прочности ковалентной связи
(5–7 ккал/моль), средняя Е образования ковалентной связи – 80–110 ккал/моль.
Образование межмолекулярных ВС между молекулами спирта можно по-
казать так: Н–О: ·∙∙·∙ Н–О: ·∙∙·∙Н–О: (водородная связь изображена точками) R R R
Химические свойства.
I. Кислотные свойства. Взаимодействие с активными металлами с обра-
зованием алкоголятов (алканолятов) металлов:
2C2H5O[H + 2Na  2C2H5ONa + H2
2C2H5ONa + H2
этанолят натрия
Эти реакции протекают только в безводной среде; в присутствии воды алкоголяты полностью гидролизуются.
II. Реакции нуклеофильного замещения (SN)
1. Взаимодействие с HHal с образованием галогеналканов:
C H [Br + H]Br |
H+ ,to |
C H |
Br + HBr |
||
|
|||||
2 |
5 |
OH-, to |
2 |
5 |
|
|
|
|
|
|
|
Спирты можно превратить в галогенпроизводные действием и других ре-
агентов, например хлоридов фосфора:
R |
|
|
OH+ PCl5 |
|
R |
|
|
Cl+POCl3 + HCl |
||||||
|
|
|
||||||||||||
R |
|
|
|
OH+ PCl |
5 |
|
|
|
3 R |
|
Cl + H PO |
3 |
||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
3 |
|||
2. Взаимодействие с аммиаком с образованием аминов (300°С).
58

vk.com/club152685050 | vk.com/id446425943
C H [OH + H]NH |
|
Al2O3, to |
C H |
|
NH2 + H2O |
||||
|
|
||||||||
|
|
|
|||||||
2 |
5 |
2 |
|
|
|
2 |
5 |
|
|
этиламин
При избытке спирта алкильными радикалами могут замещаться два или
три атома водорода в молекуле NH3 с образованием ди-и триэтиламинов.
III. Нуклеофильные свойства
Взаимодействие с органическими и неорганическими кислотами с обра-
зованием сложных эфиров (реакции этерификации):
|
|
|
O |
|
C |
|
CH3 H SO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 K t |
o |
O |
||||||||
|
|
|
|
|
|
|||||||||||
C H O |
[ |
H |
+ HO |
] |
2 |
|
|
|
|
|
+ H O |
|||||
|
|
|
|
|
|
|
|
|
|
|
||||||
2 5 |
|
|
|
|
|
|
|
|
|
CH3 C |
2 |
|||||
|
|
|
|
|
|
|
|
|
|
O |
|
C2H5 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
этиловый эфир уксусной кислоты (этилацетат)
CH OH + HONO |
|
CH |
|
O |
|
NO2 + H2O |
|
|
|
|
|||||
|
|||||||
3 |
2 |
3 |
|
|
|
||
метиловый эфир азотной кислоты (метилнитрат)
IV. Реакции отщепления (Е)
1. Дегидратация спиртов:
а) межмолекулярная дегидратация спиртов с образованием простых эфиров R–О–R'. Реакция протекает в присутствии Н2SO4(конц) и при 140°С:
C H O[H + HO]C H |
5 |
→ C2H5 |
|
O |
|
C2H5 + H2O |
||
|
|
|||||||
2 |
5 |
2 |
|
|
|
|
|
|
диэтиловый эфир (этоксиэтан)
б) внутримолекулярная дегидратация спиртов с образованием алкенов:
H H
H2SO4 K,170oC
H |
|
C |
|
C |
|
H |
|
H C |
|
CH + H O |
|
|
|
|
|
||||||
|
|
|
|
|||||||
|
|
|
|
|
|
2 |
2 2 |
|||
 H OH
H OH 
Дегидратация вторичных и третичных спиртов происходит по правилу Зай-
цева (атом водорода отщепляется от менее гидрогенизированного атома углерода). 2. Дегидрирование. При дегидрировании первичных спиртов образуются
альдегиды, при дегидрировании вторичных спиртов – кетоны:
CH |
|
CH |
|
|
CH3 |
Cu, to |
CH3 |
|
C |
|
CH |
+ H2 |
||||||
|
|
|
|
|
|
|||||||||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
H |
|
|
|
|
|
O |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
пропанол-2 (ацетон)
Третичные спирты не дегидрируются.
59

vk.com/club152685050 | vk.com/id446425943
V. Реакции окисления
1. Горение (полное окисление):
C2H5OH + 3O2 |
to |
2CO2 + 3H2O; Н0 = –1374 кДж |
2. Неполное окисление под действием окислителей: кислорода воздуха в
присутствии катализаторов (например, Сu), KMnO4, K2Cr2O7 и др. Реакции неполного окисления спиртов по своим результатам аналогичны реакциям дегид-
рирования.
|
|
H |
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
C |
|
|
|
|
O |
|
|
|
H + [O] |
|
|
|
H |
|
C |
+ H2O |
|||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
H |
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||
Получение предельных одноатомных спиртов
1. Гидратация алкенов (H3PO4, 300°C). При гидратации гомологов этиле-
на образуются вторичные или третичные спирты (прав. Марковникова).
2.Гидролиз галогеналканов (водный раствор NaOH).
3.Гидрирование альдегидов и кетонов в присутствии Ni, Pt, Pd, Co альдегиды восстанавливаются до первичных спиртов, а кетоны – до вторичных.
|
|
CH2 |
|
CH2 |
|
C |
O |
Ni |
|
OH |
CH3 |
|
|
|
+ H2 |
CH3CH2CH2CH2 |
|||||
|
|
|
|
|||||||
|
|
|
|
|
|
|
H |
|
|
|
4. Специфические способы получения метанола и этанола:
P, to , kat
CO + 2H2  CH3OH
CH3OH
синтез-газ Брожение (ферментация) углеводов – глюкозы или крахмала:
C6H12O6  2C2H5OH + 2CO2
2C2H5OH + 2CO2
Предельные многоатомные спирты. Молекулы многоатомных спиртов содержат две и более гидроксильные группы.
CH2 CH2 CH2
OH OH OH
глицерин, или пропантриол–1,2,3
Физические свойства. Глицерин – вязкая, бесцветная, сладковатая на вкус нетоксичная жидкость с tкип = 290°С.
60

vk.com/club152685050 | vk.com/id446425943
Химические свойства. Для многоатомных спиртов характерны практи-
чески все реакции, в которые вступают одноатомные спирты.
Наличие нескольких ОН-групп в молекулах многоатомных спиртов обуслов-
ливает увеличение подвижности и способности к замещению гидроксильных атомов водорода по сравнению с одноатомными спиртами. Поэтому, в отличие от алканолов, многоатомные спирты взаимодействуют с гидроксидами тяжёлых металлов (например, с гидроксидом меди (II) Сu(ОН)2). Продуктами этих реакций яв-
ляются внутрикомплексные («хелатные») соединения, в молекулах которых атом тяжёлого металла образует как обычные ковалентные связи Me–О за счёт замеще-
ния атомов водорода ОН-групп, так и донорно-акцепторные связи Me ← О за счёт неподелённых электронных пар атомов кислорода других ОН-групп:
H C |
|
|
|
O |
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
H2C |
|
|
|
O |
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
O |
|
|
CH2 |
|
||||||||||||||||||||||||
|
|
|
|
|
O.. |
|
|
|
|
|
|
|
|
|
|
|
|
|
Cu |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cu |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
HC |
|
|
|
|
+ |
|
HO |
|
|
|
|
+ H |
|
O |
|
CH |
|
|
|
|
|
|
|
O |
|
CH |
+ 2H2O |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
HC |
|
|
O |
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
||
H |
C |
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
2 |
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2C |
|
OH |
HO |
|
CH2 |
|
||||||||
глицерат меди (II), ярко-синий раствор
Эта реакция является качественной реакцией на многоатомные спирты.
Многоатомные спирты, как и одноатомные, взаимодействуют с органическими и неорганическими кислотами с образованием сложных эфиров:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
H C |
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
C |
|
|
|
|
CH3 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ 3 CH |
|
|
C |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HC |
|
|
|
|
|
|
O |
|
|
|
|
|
|
C |
|
|
|
CH3 |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- 3 H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
H2C |
|
|
|
O |
|
|
|
[H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
H2C |
|
|
|
|
O |
|
|
|
|
C |
|
CH3 |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
HC |
|
|
O |
|
|
|
[H |
|
|
|
|
|
|
|
H C |
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
NO2 |
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
H2C |
|
|
|
O |
|
|
|
|
[H |
|
+3HONO2 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(H2SO4K) |
|
HC |
|
|
|
|
O |
|
|
|
|
NO2 |
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- 3H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2C |
|
|
|
|
|
O |
|
|
|
|
|
NO2 |
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
Сложные эфиры глицерина и высших карбоновых кислот представляют собой жиры.
Получение глицерина
1. Кислотный, щелочной или ферментативный гидролиз жиров:
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
O |
|
|
|
|
|
|
|
|
OH |
||
CH2 |
|
|
|
O |
|
|
|
OR |
|
|
CH2 |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH + 3R |
|
COOH |
|||
|
|
|
|
|
O |
|
|
|
|
C |
+ 3H O |
|
|
CH |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
CH |
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
OH |
|||
|
CH |
|
|
|
O |
|
|
C |
|
|
CH2 |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
61
vk.com/club152685050 | vk.com/id446425943
2. Синтез из пропилена.
CH |
|
|
CH2 |
|
Cl |
|
CH |
|
OH |
|
CH |
|
|
OH |
||||||||||
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
3 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
2 |
|
|
|
|
||
|
|
|
|
+Cl |
|
|
|
|
|
+NaOH |
|
|
|
|
+ HO |
|
OH |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
CH |
|
2 |
CH |
- NaCl |
CH |
|
|
|
|
|
|
CH |
|
|
OH |
|||||||||
|
-HCl |
|
|
|
|
|||||||||||||||||||
|
|
(WO3) |
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
CH2 |
|
CH2 |
|
CH2 |
|
|
|
|
|
|
CH2 |
|
|
OH |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
пропилен |
аллилхлорид |
аллиловый спирт |
|
глицерин |
||||||||||||||||||||
Ароматические спирты (фенолы). Фенолы – это производные арома-
тических углеводородов, содержащие одну или несколько гидроксильных групп у атомов углерода бензольного кольца. Выделяют одноатомные фенолы,
двухатомные (арендиолы) и трёхатомные (арентриолы).
Гомологический ряд:
OH
C6H5OH
фенол, гидроксибензол (карболовая кислота)
OH
OH OH
CH3
CH3 CH3
о-крезол м-крeзол п-крезол
СН3С6Н4ОН – крезолы (метилфенолы, гидрокситолуолы).
Физические свойства. Большинство одноатомных фенолов при нор-
мальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорас-
творимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления.
Химические свойства фенолов обусловлены наличием в их молекулах функциональной группы – ОН и бензольного кольца.
Реакции с участием гидроксильной группы.
I. Кислотные свойства. Фенол диссоциирует в водных растворах с обра-
зованием фенолят-ионов и ионов водорода.
1. Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов):
62
vk.com/club152685050 | vk.com/id446425943
OH |
ONa |
+ NaOH |
+ H2O |
фенолят натрия
2. Взаимодействие с активными металлами (сходство со спиртами):
OH OK
2 |
+ 2K |
2 |
+ H2 |
Фенол более слабая кислота, чем угольная:
ONa |
OH |
|
|
|
|
|
|
|


 + H2O +CO2
+ H2O +CO2 


 + NaHCO3
+ NaHCO3
H2CO3
Реакции с участием бензольного кольца.
II. Реакции замещения (SE). Реакции замещения в бензольном кольце фенолов протекают легче, чем у бензола, и в более мягких условиях.
1. Галогенирование:
|
|
|
OH |
OH |
|
OH |
|
|
|
|
-HCl |
|
Cl |
|
2 |
+ 2Cl2 |
|
||
|
+ |
|||
|
|
|
|
Cl
о-хлорфенол п-хлорфенол
OH
OH
Br Br
+ 3Br2 |
+ 3HBr |
(H2O)
Br
2,4,6-трибромфенол
63
