
Химия нефти
.pdfvk.com/club152685050 | vk.com/id446425943
д) СН3 – СН = СН – СН = СН – СН – СН = СН2
│
СН3
104.Сколько брома может присоединиться к 30 г бутадиена-1,3?
105.Чем объясняется высокая химическая активность диеновых углево-
дородов? В какие реакции они вступают? Приведите примеры.
106.Напишите все изомеры для углеводорода С5Н8.
107.Назовите по систематической номенклатуре IUPAC следующие углеводороды:
а) СН2= СН – СН = СН2 |
в) СН3 – СН = СН – СН = СН – СН3 |
б) СН2 = С – С = СН2 |
г) СН2 = СН – С ≡ С – СН = СН2 |
│ │ |
|
СН3 СН3 |
|
д) СН3 – СН2 – С – СН2 – С – СН3
║ |
║ |
|
СН2 |
СН2 |
|
108. Составьте структурные формулы углеводородов: |
||
а) 2,5-диметилгексадиен-1,5; |
в) 2,7-диметилоктадиен-3,5; |
|
б) гексадиен-2,4; |
|
г) 2-этилпентадиен-1,3. |
109.Предложите схему получения изопрена из пентановой фракции
нефти.
110.Напишите уравнения реакций получения хлоропрена из метана и необходимых неорганических веществ.
111.Напишите уравнения реакций между следующими веществами:
а) 2-метилбутадиеном-1,3 и бромоводородом; б) пентадиеном-1,4 и хлором.
112. Напишите уравнения взаимодействия брома со следующими углеводородами:
а) пентадиеном-1,4; б) пентадиеном-1,3.
113.Исходным сырьём для получения хлоропренового каучука является ацетилен: ацетилен → винилацетилен → хлоропрен → полимер хлоропрена.
Напишите уравнения реакций получения хлоропренового каучука. Чем отличается каучук от резины?
114.Вулканизация каучука связана с взаимодействием серы с молекулами каучука. Приведитесхемуреакциисерыснатуральнымибутадиеновым каучуками.
115.Осуществите следующие превращения:
а) СН2 = СН – СН = СН2 → ClCH2 – CHBr – CHBr – CH3; б) СН2 = СН – СН = СН2 → BrCH2 – СН2 – СНCl – СН2Br.
44

vk.com/club152685050 | vk.com/id446425943
116.Получите 1,5-гексадиен по реакции Вюрца, по реакции Гриньяра–
Вюрца.
117.Предложите пути синтеза бутадиена-1,3, используя в качестве исходного вещества ацетилен:
|
О |
ОН |
О |
|
? |
│ |
|
|
СН3 – С → СН3 – СН – СН2 – С |
|
|
|
Н |
|
Н |
|
? |
|
|
СН ≡ СН – |
СН2 = СН – С ≡ СН → СН2 = СН –СН – СН2 |
||
?СН ≡ С – СН2 – ОН → СН2ОН – С ≡ С – СН2ОН
118.Напишите уравнения реакций дегидратации следующих соединений
(катализатор – оксид алюминия):
|
|
СН3 СН3 |
|
|
│ │ |
а) СН3 – СН – СН2 – СН – СН3 |
б) СН3 – СН2 – С – С – СН3 |
|
│ |
│ |
│ │ |
ОН |
ОН |
ОН ОН |
в) СН3 – СН = СН – СН – СН3
│
ОН 119. Бутадиен-1,3 по-разному реагирует с водородом. Напишите уравне-
ния реакций гидрирования бутадиена-1,3: а) натрием (в спирте);
б) водородом в присутствии катализатора (никель, платина).
120. Напишите структурные формулы всех диеновых углеводородов,
при гидрировании которых получается 2-метилпентан. Назовите их по номенклатуре IUPAC.
3.7 Алкины
Алкины – непредельные или ненасыщенные УВ, которые содержат одну тройную связь. Их характеристики: 1) общая формула СnH2n-2; 2) атомы углерода при кратной связи находятся в состоянии sp-гибридизации, угол между связями C–C 180°, длина связи С–С равна 0,120 нм; 3) обладают высокой реакционной способностью, характерны реакции присоединения, полимеризации.
Гомологический ряд: С2Н2 – этин (ацетилен), С3Н4 – пропин и т. д.
45
vk.com/club152685050 | vk.com/id446425943
Изомерия: 1) углеродного скелета; 2) положения кратной связи; 3) меж-
классовая (изомерны алкадиенам); 4) оптическая.
Физические свойства. При обычных условиях С2Н4...С4Н8 – газы,
С5Н10…C15H32 – жидкости, С16Н34 – твёрдые вещества. Плохо растворимы в воде. Химические свойства. Обладают большей реакционной способностью,
чем алкены. Так как тройная связь содержит две π-связи, алкины могут вступать в реакции двойного присоединения (присоединять две молекулы реагента по тройной связи). Присоединение несимметричных реагентов к несимметричным алкинам происходит по правилу Марковникова.
I. Реакции присоединения (AE). Алкины менее активны в реакциях электрофильного присоединения, чем алкены.
1. Гидрирование алкинов протекает при тех же условиях, что и алкенов, но медленнее (на I ступени образуются алкены, на II – алканы):
CH |
|
CH+ H |
Pt, Pd |
CH |
|
CH2 |
|
Pt, Pd |
|
CH3 |
||
|
|
|
|
|
|
CH |
|
|||||
|
|
|
|
|
|
|
||||||
|
|
2 Ni, 150oC |
2 |
|
Ni, 150oC 3 |
|||||||
2. Галогенирование (на I ступени образуются дигалогеналкены, на II – тетрагалогеналканы):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|
Br |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
1 |
2 |
3 |
4 |
1 |
|
2 |
|
|
3 |
4 |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
CH + Br |
|
|
|
|
|
C |
|
CH |
|
CH3 |
|
|
|
|
|
|
|
|
|
CH |
|
|
CH |
|
CH CH2 |
|
|
|
CH |
|
|
|
|
CH |
|
C |
CH2 |
|
|
||||||||||||
|
3 |
2 |
|
|
|
|
2 |
|
|
|
|
|
|
3 |
||||||||||||||
|
|
|
|
|
|
(H2O) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
Br |
|
|
Br |
|
|
|
|
|
|
Br |
|
|
Br |
|
|
|
|
|
Реакция алкинов с бромной водой является качественной на алкины. 3. Гидрогалогенирование:
HC |
|
CH |
|
+ HCl |
CH |
|
CHCl |
|
+HCl |
CH |
|
CHCl2 |
||
|
|
|
||||||||||||
|
|
|
|
|
|
|||||||||
|
|
|
|
|||||||||||
|
|
|
Cu+,Hg + |
2 |
|
|
Cu+,Hg2+ |
3 |
|
|||||
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
4. Гидратация протекает легче, чем гидратация алкенов. При гидратации ацетилена образуется альдегид, гомологи ацетилена образуют кетоны (реакция М. Г. Кучерова):
H
HC CH + H OH |
Hg+ |
CH |
CH3 C |
CH2 |
|||
|
|
O H |
O |
виниловый спирт
Виниловый спирт является неустойчивым соединением и изомеризуется в альдегид – уксусный альдегид, ацетальдегид (вторичные спирты – в кетоны).
46

vk.com/club152685050 | vk.com/id446425943
5. Присоединение синильной кислоты:
HC≡CH + HCN → CH2=CH–CN
акрилонитрил
Акрилонитрил – важный продукт для получения синтетического волокна. 6. Присоединение спиртов, карбоновых кислот:
СH3COOH + HC≡CH → СH3COO–CH=CH2
винилацетат
HC≡CH + HO–С2H5 → СH2=CH–O–С2H5
Полученные продукты применяет как мономеры для получения высоко-
молекулярных соединений.
II. Реакции окисления
1. Горение (полное окисление):
to
2C2H2 + 5O2  4CO2 + 2H2O
4CO2 + 2H2O
2. Неполное окисление (под действием КМnО4, К2Сr2О7) протекает с разрывом молекулы по тройной связи (кроме ацетилена):
O O
CH |
3 |
|
C |
|
CH + 3[O] + H O |
|
CH |
3 |
|
C |
+ H |
|
C |
|
|
||||||||||||
|
|
|
|
|
|||||||||
|
|
|
2 |
|
|
|
|
|
|
|
|||
OH OH
При неполном окислении ацетилена образуется двухосновная щавелевая кислота.
Реакция с КМnO4 является качественной реакцией на алкины. Раствор КМnO4 обесцвечивается.
III. Реакции полимеризации
Алкины могут образовывать линейные димеры, тримеры и полимеры,
циклические тримеры.
Линейная полимеризация ацетилена происходит в присутствии солей Сu+
(Ньюленд):
3HC |
|
CH |
CuCl,H+ |
CH |
|
CH |
|
C |
|
C |
|
CH |
|
CH2 |
||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
(NH4Cl) |
2 |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
дивинилацетилен (тример)
Циклотримеризация алкинов приводит к бензолу и другим ароматическим УВ (Н. Д. Зелинский, Б. А. Казанский):
3HC |
|
CH |
400oC |
|
|||
|
C |
||
|
|||
|
|
|
47
vk.com/club152685050 | vk.com/id446425943
IV. Реакции замещения атомов «Н», связанных с sp-гибридизованными атомами углерода (реакции металлирования).
Атомы водорода, связанные с sp-гибридизованными атомами углерода,
обладают значительной подвижностью. Атомы водорода могут замещаться атомами металлов, в результате чего образуются ацетилениды.
2HC |
|
|
|
CH+2Na |
NH3 |
2HC |
|
|
|
CNa + H2 |
|||||||||
|
|
|
|||||||||||||||||
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
||||||||||||
CH3 |
|
|
C |
|
|
|
|
|
NH4OH |
|
|
|
C |
|
|
|
|||
|
|
|
|
CH + CuCl |
|
CH3 |
|
|
CCu + HCl |
||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
||||||||||||
метилацетиленид меди (I)
Получение алкинов
1. Получение ацетилена. В промышленности ацетилен получают терми-
ческим разложением природного газа или УВ нефти:
|
|
|
1000oC |
|||||
2CH4 |
|
|
|
|
CH |
|
|
CH + 3H2 |
|
|
|
|
|||||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
1200oC |
|||||||
C2H6 |
|
|
|
|
C2H2 + 2H2 |
|||
|
|
|
|
|||||
В лаборатории – гидролизом карбида кальция:
CaC2 + 2H2O  Ca(OH)2 + C2H2
Ca(OH)2 + C2H2
2. Получение гомологов ацетилена:
Дегидрогалогенирование дигалогеналканов (–2ННаl) действием спирто-
вого раствора щёлочи или твёрдой щёлочи при нагревании:
|
|
|
|
|
|
H |
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
toC |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
CH |
|
|
CH2 |
|
|
C |
|
C |
|
|
CH3 |
+ 2NaOH |
|
CH2 |
|
C |
|
C |
|
CH + 2NaBr + 2H O |
|||||
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
2 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Задания к разделу «Алкины»
121. Какие виды изомерии характерны для углеводородов гомологическо-
го ряда ацетилена? Привести примеры.
122. Напишите структурные формулы изомерных ацетиленовых углево-
дородов состава С7Н12, главная цепь которых состоит из пяти углеродных ато-
мов, и назовите их.
123. Ацетилен массой 15,6 г присоединил хлороводород массой 43,8 г.
Установите структуру продукта реакции.
48
vk.com/club152685050 | vk.com/id446425943
124. Рассчитайте элементный состав (в % по массе) изомерных ацетиле-
новых углеводородов, плотность паров которых по кислороду равна 1,69. Напишите структурные формулы возможных изомеров.
125.Какая масса карбида кальция вступила в реакцию с водой, если при этом выделилось 5,6 л ацетилена (н.у.)?
126.Составьте уравнение полного сгорания ацетиленового углеводорода, являющегося вторым членом гомологического ряда ацетиленовых углеводоро-
дов, и рассчитайте, сколько литров воздуха потребуется для сгорания 5,6 л этого углеводорода.
127.Приведите формулу простейшего алкина с разветвлённым углеродным скелетом, приведите три реакции, описывающие свойства этого соединения.
128.Исходя из ацетилена и неорганических реактивов, получите метан.
129.Получите уравнения реакций: а) ацетилен из этилена; б) бутин-2 из бутена-2. Напишите уравнения реакций.
130.В трёх запаянных ампулах находятся три разных газа: метан, угле-
кислый газ, ацетилен. Опишите, как, основываясь на различии в химических и физических свойствах, можно надёжно определить, где какой газ находится.
Приведите необходимые уравнения реакций.
131. Сколько алкинов могут быть изомерны изопрену? Напишите струк-
турные формулы этих алкинов и назовите их.
132. Напишите уравнения реакций, с помощью которых можно осуще-
ствить превращения:
1-хлорбутан → бутен-1 → 1,2-дибромбутан → бутин-1
Укажите условия протекания реакций.
133. При гидрировании ацетилена объёмом 672 мл (н.у.) получили смесь этана и этилена, которая обесцвечивает раствор брома в тетрахлориде углерода массой 40 г, массовая доля брома в котором составляет 4 %. Определите массо-
вые доли углеводородов в полученной смеси.
134. При пропускании ацетилена в спиртовой раствор йода получено со-
единение, содержащее 90,7 % йода и 0,7 % водорода по массе. Найдите формулу этого вещества.
135. Указатель уровня в цистернах с жидким кислородом обычно заполняется тетрабромэтаном, который получают из ацетилена. Напишите схему ре-
акции образования этого соединения.
136. Ацетилен, хранящийся в баллоне в виде раствора в ацетоне, очища-
ют, пропуская его через воду и затем через концентрированную серную кислоту. Каково здесь назначение воды и серной кислоты?
49
vk.com/club152685050 | vk.com/id446425943
137. Напишите формулы строения изомерных углеводородов состава
С4Н6 и С5Н8.
138.Сколько воздуха по объёму потребуется для сжигания 1м3 1-бутина?
139.Сколько ацетилена по объёму (н.у.) потребуется, чтобы получить 44,25 г хлоропрена?
140.Сколько ацетилена и водорода по объёму (н.у.) можно получить из 1042 м3 природного газа, который содержит 0,96 объёмных долей, или 96 % (по объёму), метана?
3.8 Арены
Арены – это УВ, молекулы которых содержат одно или несколько бензольных колец.
Арены ряда бензола (моноциклические арены). Их характеристики: 1) общая формула СnH2n-6; 2) атомы углерода в бензольном кольце находятся в состоянии sp2-гибридизации, угол между связями C–C 120°, молекула плоская, длина связи – 0,140 нм; 3) имеют ковалентные σ- и π-связи; 4) характерные реакции – замещения;
присоединения (протекают труднее); полного и частичного окисления.
Электронное строение молекулы бензола. Первая структура бензола была предложена в 1865 г. немецким учёным А. Кекуле: бензол представляет собой шестичленный цикл с сопряжёнными связями (чередуются простые и двойные связи) – циклогексатриен–1,3,5:
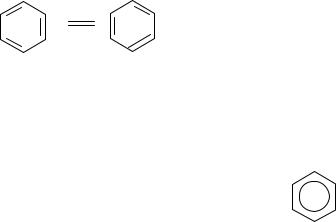
Но в молекуле бензола между углеродными атомами нет чисто простых и двойных связей, а все они выровнены. Поэтому структурную формулу бензола изображают в виде правильного шестиугольника (σ-скелет) и кружка внутри него, обозначающего делокализованные π-связи:
Сочетание шести σ-связей с единой π-системой называется ароматиче-
ской связью. Цикл из шести атомов углерода, связанных ароматической связью, называется бензольным кольцом, или бензольным ядром.
Гомологический ряд: бензол С6Н6, толуол С6Н5СН3 (метилбензол) и т. д. Название радикалов: С6Н5- – фенил; С6Н5СН2- – бензил.
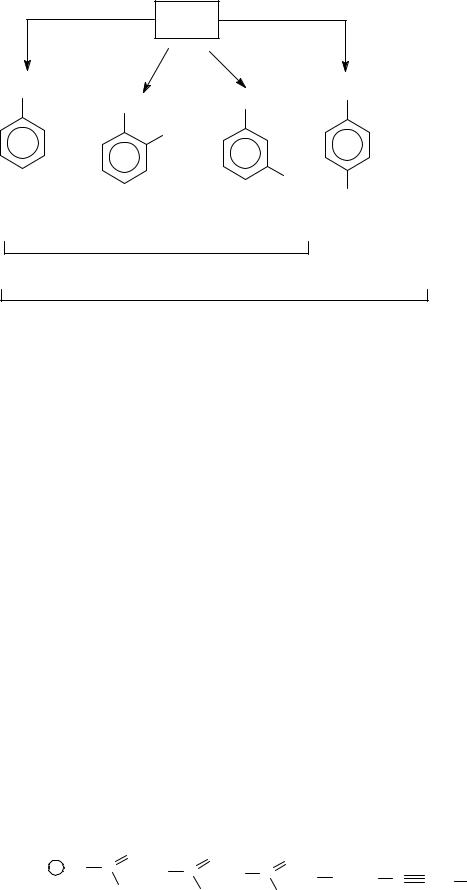
Изомерия боковой цепи (кроме бензола и толуола):
50
vk.com/club152685050 | vk.com/id446425943
C8H10
|
C2H5 |
CH3 |
CH3 |
|
CH3 |
|
|
|
|
CH3 |
|
|
|
|
CH3 |
|
|
|
CH3 |
1 |
2 |
3 |
4 |
изомерия положения заместителей
изомерия числа и строения заместителей
1 – этилбензол (фенилэтан); 2 – 1, 2-диметилбензол, орто-диметилбензол (о-ксилол); 3 – 1,3-диметилбензол, мета-диметилбензол (м-ксилол); 4 – 1,4-диметилбензол,
пара-диметилбензол (п-ксилол).
Физические свойства. Бензол и толуол при обычных условиях бесцвет-
ные жидкости. Высшие гомологи – твёрдые вещества. Имеют характерный запах; не смешиваются с водой, хорошие растворители, токсичны. Толуол менее токсичен, чем бензол.
Направляющее (ориентирующее) действие заместителей в бензольном кольце: электронная плотность в кольце бензола распределена равномерно, заместитель нарушает эту равномерность. Заместители-ориентанты:
- заместители I рода (электронодоноры – Д) подают электроны на бензольное кольцо и увеличивают электронную плотность в орто- и пара-
положениях. Направляют второй заместитель (Е) в орто- и пара-положения бензольного кольца. Облегчают реакции замещения атомов водорода, связан-
ных с бензольным ядром.
Д= – Hal < – СН3 < –CH2R < – CR3 < – OR < –OH< – NH2 < – NHR < –NR2
- заместители II рода (электроноакцепторы – A) оттягивают электроны от бензольного кольца. Направляют второй заместитель (Е) в мета-положение. Затрудняют реакции замещения по сравнению с незамещённым бензолом.
|
O |
|
O |
|
O |
|
A = |
C |
< C |
< |
C |
< |
SO3H < C N < NO2 |
|
OR |
|
OH |
|
||
|
|
|
H |
|
51
vk.com/club152685050 | vk.com/id446425943
Химические свойства
I. Реакции замещения (SE)
1. Галогенирование:
[H |
FeBr2 |
Br |
|
+ Br2 |
+ HBr |
||
|
В толуоле метильный радикал направляет заместители в орто- и пара- положения. Реакции с участием боковой цепи: метильная группа в метилбензо-
ле может вступать в реакции, характерные для алканов (SR):
CH3 CH2Cl
to, hv
+ Cl2 |
+ HCl |
хлорметилбензол (бензилхлорид)
2. Нитрование бензола и его гомологов проводят в присутствии смеси концентрированных азотной HNO3 и серной H2SO4 кислот (нитрующая смесь). При нитровании толуола получают 2,4,6-тринитротолуол:
|
CH3 |
|
CH3 |
||||||
|
|
|
|
|
|
O2N |
|
||
|
|
|
|
|
|
|
|
NO2 |
|
|
|
||||||||
|
|
|
|
H2SO4 K |
|
|
|
||
|
|
+ 3 HO |
|
NO2 |
|
|
|
|
+ 3H2O |
|
|
|
to |
|
|
|
|||
|
|
||||||||
NO2
3. Сульфирование происходит действием на арены H2SO4(конц).:
[H |
|
to |
|
|
SO3H |
|
+ HO |
] |
SO H |
|
|
+ H O |
|
|
|
|||||
|
|
3 |
|
|
|
2 |
бензол-сульфокислота (сульфобензол)
4. Алкилирование (замещение атома «Н» на алкильную группу) – реакции Фриделя–Крафтса, образуются гомологи бензола:
[ H |
AlCl3 |
|
C2H5 |
|||
+ C2H5 |
|
Cl |
|
+ HCl |
||
|
|
|
|
|||
CH2 CH3
H+
+ CH2 CH2
CH2
52

vk.com/club152685050 | vk.com/id446425943
II. Реакции присоединения (АR)
1. Гидрирование:
Ni
+ 3H2 150-160oC, P
2. Присоединение хлора:
Cl
Cl Cl
hv
+ 3Cl2
Cl Cl
Cl
гексахлорциклогексан (гексахлоран)
III. Реакции окисления
1. Горение:
2С6Н6 + 15O2 → 12СO2 + 6Н2O
2.Неполное окисление. Бензол окисляется кислородом воздуха при 400°С
вприсутствии V2O5 в малеиновый ангидрид. Гомологи бензола окисляются обычными окислителями; при этом окислению подвергается боковая цепь, в случае толуола – метильная группа. Мягкие окислители типа МnO2 окисляют её до альдегидной группы (образуется бензальдегид), более сильные окислители (КМnO4) вызывают дальнейшее окисление до бензойной кислоты. Любой гомолог бензола с одной боковой цепью окисляется сильным окислителем типа КМnO4 в бензойную кислоту, т. е. происходит разрыв боковой цепи с окислением отщепившейся её части до СO2:
|
O |
|
CH2 CH3 |
C |
OH |
+ 6[O] |
|
+ 2H2O+CO2 |
u3KMnO4 |
|
|
бензойная кислота
При наличии нескольких боковых цепей каждая из них окисляется до карбоксильной группы и в результате образуются многоосновные кислоты.
Получение аренов 1. В промышленности:
-переработка нефти и угля;
-дегидрирование соответствующих циклогексанов (Н. Д. Зелинский):
53
