
Химия нефти
.pdf
vk.com/club152685050 | vk.com/id446425943
2. Нитрование:
OH |
OH |
H2SO4 O2N |
NO2 |
+ 3HONO2 |
+ 3H2O |
NO2
2,4,6-тринитрофенол (пикриновая кислота)
3. Сульфирование:
|
|
|
OH |
|
to |
KOMH |
SO3H |
|
OH |
|
+ H2O |
|
|
|
|
2 |
+ 2 H2SO4 |
|
OH |
|
|
|
|
|
to=100oC |
+ H2O |
|
SO3H
III. Реакции присоединения (A).
1. Гидрирование:
OH OH
Ni
+ 3H2 150oC, P
циклогексанол
Качественные реакции на фенолы – взаимодействие растворов одно-
атомных фенолов с хлоридом железа (III) FeCl3 с образованием комплексных фенолятов, которые имеют фиолетовую окраску.
Получение фенолов
1. Из каменноугольной смолы. Каменноугольную смолу, содержащую в качестве одного из компонентов фенол, обрабатывают вначале раствором щёлочи (образуются феноляты), а затем – кислотой:
C6H5OH + NaOH  C6H5ONa + NaOH
C6H5ONa + NaOH
C6H5ONa + H2SO4  C6H5OH + NaHSO4
C6H5OH + NaHSO4
64

vk.com/club152685050 | vk.com/id446425943
2. Кумольный способ.
|
|
CH3 |
|
|
|
+ CH3 CH |
AlCl3 |
C H |
+O2 |
|
|
CH2 |
CH3 |
|
kat |
|
|
|
|
|
o |
||
|
|
|
110-130 C |
||
CH3 |
OH |
|
|
|
|
|
|
|
|
|
|
C |
O OH |
|
|
+ CH3 C CH3 |
|
|
|
|
|
||
CH3 |
|
|
|
O |
|
|
|
|
|
|
|
В результате этих процессов получают два промышленно важных продукта – фенол и ацетон.
3. Сплавление солей аренсульфокислот со щёлочью:
SO3Na OH
+ NaOH |
+ Na2SO3 |
4. Взаимодействие галогенпроизводных ароматических УВ со щелочами:
Cl |
OH |
+ NaOH 300oC, P |
+ NaCl |
Cu |
|
или с водяным паром
Cl 450-500oC
 OH
OH
+ H2O |
+ HCl |
Al2O3
3.9.1.2 Альдегиды (оксосоединения)
Карбонильные соединения (оксосоединения) – это производные УВ, содержащие в молекуле карбонильную группу > С = О.
Альдегиды – это органические соединения, молекулы которых содержат альдегидную группу, связанную с углеводородным радикалом.
O
C
H альдегидная группа
Их характеристики: 1) общая формула СnH2nО; 2) карбонильный атом уг-
лерода находится в sp2-гибридизации; 3) за счёт электронных эффектов двойная связь С = О оказывается сильно поляризованной, что и объясняет высокую ре-
акционную способность альдегидов.
65
vk.com/club152685050 | vk.com/id446425943
Гомологический ряд предельных альдегидов: НСОН – метаналь (мура-
вьиный альдегид), СН3СОН – этаналь (уксусный альдегид) и т. д.
Изомерия: 1) углеродного скелета; 2) межклассовая (изомерны кетонам); 3) оптическая; 4) кето-енольная таутомерия.
Физические свойства. При обычных условиях НСОН – газ, С2 ... С12 –
жидкости, с С13 – твёрдые вещества. Низшие альдегиды имеют резкий запах, высшие альдегиды, содержащие 8–12 атомов «С», – душистые вещества. Аль-
дегиды раздражают слизистые оболочки глаз и верхних дыхательных путей, вредно влияют на нервную систему.
Химические свойства.
I. Реакции присоединения (AN)
1. Гидрирование:
|
|
|
O |
Ni (Pt) CH3 |
|
|
CH3 |
|
C |
+ H2 |
|
CH2OH |
|
|
|
|||||
|
|
|
H |
|
|
|
2. Присоединение спиртов с образованием полуацеталей (неполные простые эфиры двухатомных спиртов, содержащих ОН-группы у одного атома углерода):
CH3 |
|
|
|
|
|
|
CH3 |
OC2H5 |
||
C |
|
O + C H |
O |
H |
|
|
C |
|
|
|
|
|
|||||||||
|
||||||||||
|
|
|||||||||
|
2 |
5 |
|
|
|
H |
|
OH |
|
|
H |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
1-этоксиэтанол–1 (полуацеталь)
Гидроксильная группа полуацеталей (полуацетальный гидроксил) очень реакционноспособна. В присутствии катализатора – хлороводорода НС1 и в из-
бытке спирта образуются ацетали RCH(OR')2 – полные простые эфиры двухатомных спиртов:
CH3 |
OC2H5 |
|
|
|
|
|
|
HCl |
CH3 |
OC2H5 |
|||
|
C |
|
|
|
|
+ C2H5OH |
C |
+ H2O |
|||||
|
|
||||||||||||
H |
|
OH |
|
|
|
|
|
|
|
H |
OC2H5 |
||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,1-диэтоксиэтан (ацеталь)
3. Присоединение гидросульфита натрия NaHSO3:
CH3 |
+ - |
CH3 |
OH |
||
C |
|
O + H SO3Na |
|
|
C |
|
|
|
|||
|
|
|
|||
H |
|
|
|
H |
SO3Na |
|
|
|
|
|
гидросульфитное производное этаналя |
66

vk.com/club152685050 | vk.com/id446425943
II. Реакции окисления
Альдегиды легко окисляются до карбоновых кислот различными окислителями (O2 воздуха, К2Сr2O7 или КМnO4; аммиачный раствор оксида серебра
(I), щелочной раствор сульфата меди (II) и др.).
1. Взаимодействие с аммиачным раствором оксида серебра (I) – «реакция серебряного зеркала».
2AgNO3 + 2NH4OH →Ag2O + 2NH4NO3 + H2O
|
|
|
O |
|
|
|
O |
||
|
|
C |
to ,NH4OH |
|
|
C |
|||
CH3 |
|
+ Ag2O |
|
|
CH3 |
|
+ 2Ag |
||
|
|
|
|
||||||
|
|
||||||||
|
|
|
H |
|
|
|
OH |
||
|
|
|
|
|
|
|
|||
Металлическое серебро осаждается на стенках пробирки в виде тонкого слоя, образуя зеркальную поверхность (качественная реакция).
2. Взаимодействие с гидроксидом меди (II). Для реакции используют свежеприготовленный Сu(ОН)2. Реакция является качественной на альдегиды.
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
CH2 |
|
C |
|
+2 |
t |
o |
|
|
CH2 |
|
C |
+1 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
CH |
3 |
|
|
|
+ 2Cu(OH) |
|
|
CH |
3 |
|
|
+ Cu O |
+ 2H O |
||||
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
2 |
2 |
||
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
OH |
|
кирпично-красный осадок
III. Реакции полимеризации (характерны для низших альдегидов)
1. Линейная полимеризация (происходит образование полимера с
п = 8 – 100 – параформальдегида): nНСОН(водн.)→[-CH2O-]n
Полимеризация безводного формальдегида в присутствии Fe(CO)5 приводит к образованию полиформальдегида (n = 1000).
2. Циклическая полимеризация (тримеризация, тетрамеризация).
H |
O |
CH2 |
||||||||
|
|
|
+ o |
O |
||||||
3 C |
|
O |
H , t |
|
|
|
|
|
|
|
|
|
H2C |
CH2 |
|||||||
H |
||||||||||
|
|
|
O |
|||||||
триоксан (триоксиметилен)
Уксусный альдегид образует циклические тример и тетрамер.
IV. Реакции поликонденсации
Реакции поликонденсации – это процессы образования высокомолеку-
лярных веществ, в ходе которых соединение исходных мономерных молекул сопровождается выделением таких низкомолекулярных продуктов, как Н2О,
НCl, NH3 и т. д.
В кислой или щелочной среде при нагревании формальдегид образует с фенолом фенолформальдегидные смолы различного строения:
67

vk.com/club152685050 | vk.com/id446425943
|
OH |
|
OH |
|
|
|
|
|
O |
H+ |
CH2 |
n |
+ n H C |
(OH-) |
+ nH2O |
|
H |
|
n |
|
|
|
Получение альдегидов
Общие методы получения:
1. Окисление первичных спиртов: - каталитическое:
|
Cu |
|
|
|
O |
2CH3OH + O2 |
2H |
|
C |
+ 2H2O |
|
to |
|
||||
|
|
|
H
- под действием окислителей (К2Сr2O7 или КМnO4 в кислой среде):
|
to |
|
|
C |
O |
|
CH3CH2OH + [O] |
CH3 |
|
+ H2O |
|||
|
||||||
|
||||||
|
|
|
|
|
H |
2. Каталитическое дегидрирование первичных спиртов:
O
Cu, 300oC
C2H5OH |
|
CH3 |
|
C |
+ H2 |
|
|
||||
|
|
|
|
|
H |
Этот способ получения объясняет суть названия «альдегид» (от лат. alcohol dehydrogenatus – спирт, от которого «отняли» водород).
3. Гидролиз дигалогеналканов, содержащих два атома галогена у первого углеродного атома:
|
OH- |
|
|
|
O |
|
CH3CHCl2 + H2O |
CH3 |
|
C |
+ 2HCl |
||
|
||||||
|
||||||
|
|
|
|
|
H |
Специфические методы получения:
- каталитическое окисление метана:
CH4 + O2 |
Mn2+ |
, 500oC |
|
C |
O |
|
|
|
H |
|
+ H O |
||
|
|
|
||||
|
|
|
|
|
|
2 |
|
|
|
|
|
|
H |
- реакция Кучерова:
|
|
|
Hg2+ |
|
|
O |
HC |
|
CH + H O |
|
CH3 |
|
C |
|
|
|||||
|
||||||
|
2 |
|
|
|
H |
|
|
|
|
|
|
|
|
- каталитическое окисление этилена:
68
vk.com/club152685050 | vk.com/id446425943
|
|
|
PdCl2+CuCl2 |
|
|
O |
2CH2 |
|
CH2 + O2 |
2CH3 |
|
C |
|
|
||||||
|
|
|||||
|
|
|
||||
|
|
|
|
|
|
H |
Аналогично могут быть получены и другие альдегиды при окислении го-
мологов этилена, например:
|
|
|
|
|
PdCl2+CuCl2 |
|
|
|
|
O |
2CH3 |
|
CH |
|
CH2 + O2 |
2CH3 |
|
CH2 |
|
C |
|
|
|
|
|
|||||||
|
|
|||||||||
|
|
|
||||||||
|
|
|||||||||
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
H |
3.9.1.3 Карбоновые кислоты
Карбоновые кислоты – это производные УВ, содержащие в молекуле одну или несколько карбоксильных групп – COOH. Карбоксильная группа (карбоксил) – сложная функциональная группа, состоящая из карбонильной и гидроксильной групп:
O
C
OH
Количество карбоксильных групп определяет основность кислоты. Характеристики карбоновых кислот: 1) общая формула СnН2nO2;
2) карбоксильный атом углерода находятся в sp2-гибридизации; 3) связь С=О сильно поляризована, свойства гидроксильной и карбонильной групп в карбо-
новых кислотах отличаются от свойств соответствующих групп в спиртах и альдегидах; 4) диссоциируют с образованием Н+; 5) не характерны реакции присоединения по связи С=О.
Гомологический ряд предельных карбоновых кислот: НСООН – мета-
новая (муравьиная) кислота, СН3СООН – этановая (уксусная) кислота, СН3(СН2)2СООН – бутановая (масляная) кислота и т. д.
Изомерия: 1) углеродного скелета; 2) межклассовая (изомерны сложным эфирам); 3) оптическая.
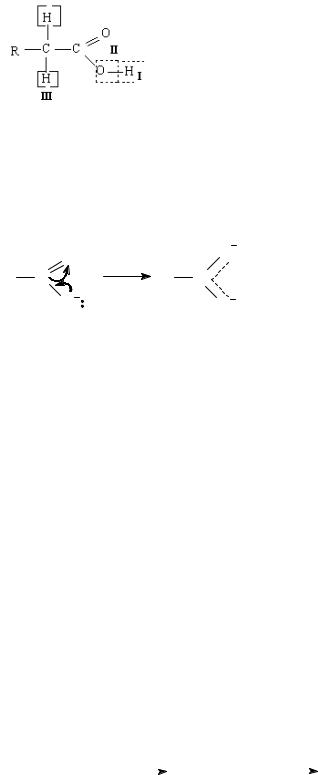
Физические свойства. При обычных условиях С1...С9 – жидкости,
с С10 ...– твёрдые вещества. В твёрдом и жидком состояниях молекулы насыщенных монокарбоновых кислот димеризуются в результате образования меж-
ду ними водородных связей:
|
|
O : ......... H |
|
O |
||||
|
|
|
||||||
R |
|
C |
C |
|
R |
|||
|
||||||||
|
|
|||||||
|
|
O |
|
H .......... |
:O |
|||
|
|
|
||||||
Водородная связь в кислотах сильнее, чем в спиртах. В водных растворах кислоты образуют линейные димеры.
69
vk.com/club152685050 | vk.com/id446425943
Химические свойства.
I. Кислотные свойства.
1. Диссоциация. В водных растворах монокарбоновые кислоты диссоции-
руют с образованием карбоксилат-ионов. Карбоксилат-ион построен симметрично, отрицательный заряд делокализован между атомами кислорода карбоксильной группы:
O |
O 1/2 |
|
|
R C |
R C |
O |
O 1/2 |
Карбоновые кислоты – слабые кислоты. В гомологическом ряду кислот их сила уменьшается с ростом числа атомов углерода в молекуле:
2. Взаимодействие с активными металлами, основными оксидами, щелочами (р. нейтрализации), аммиаком, солями более слабых кислот.
2НСООН + Са → (HCOO)2Са + Н2↑
формиат кальция СН3СН2СООН + NaОН → СН3СН2СООNa + Н2О
пропионат натрия СН3СООН + NH3 → CH3COONH4
ацетат аммония
СН3СН2СН2СООН + КHCО3 → CH3CH2CH2COOК + CО2↑ + H2О
бутират калия
II. Реакции замещения (SN) ОН-группы.
1.Взаимодействие со спиртами (см. свойства спиртов).
2.Взаимодействие с аммиаком с образованием амидов кислот.
|
|
O |
|
|
|
|
|
O |
|
|
|
|
|
O |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
to |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
NH2 + H2O |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
CH3 |
|
C |
|
OH + NH3 |
|
CH3 |
|
C |
|
ONH4 |
|
CH3 |
|
|
||||||||
|
|
|||||||||||||||||||||
ацетамид
3. Взаимодействие с галогенидами фосфора (РС15, РСl5) или тионилхлоридом SOCl2 с образованием галогенангидридов.
70

vk.com/club152685050 | vk.com/id446425943
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
CH3 |
|
|
|
|
|
C |
|
|
|
OH + PCl5 |
|
|
CH3 |
|
|
|
|
|
C |
|
Cl + POCl3 + HCl |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ацетилхлорид |
|
||||||||||
|
|
|
O |
|
|
|
|
|
|
|
|
|
O |
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
H |
|
|
C |
|
|
|
|
OH + SOCl |
|
|
|
H |
|
|
C |
|
Cl + SO |
2 |
+ HCl |
|||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
формилхлорид
4. Межмолекулярная дегидратация карбоновых кислот:
|
|
O |
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
O |
|
|
|
O |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P2O5 |
|
|
|
|
|
|
|
|
|
|
|
CH3 + H2O |
||
|
|
C |
|
OH |
+ H |
|
O |
|
C |
|
CH3 |
|
C |
|
O |
|
C |
|
|||||||||||||||
CH3 |
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
t |
o |
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
уксусный ангидрид (ангидрид уксусной кислоты)
Смешанные ангидриды карбоновых кислот можно получить при взаимодействии хлорангидрида одной кислоты и соли другой кислоты.
III. Реакции замещения у α-углеродного атома. Атомы водорода у α-
углеродного атома более подвижны, чем другие атомы водорода в радикале кислоты, и могут замещаться на атомы галогена с образованием α- галогенкарбоновых кислот:
CH3COOH + Cl2 |
PCl5, hv, to |
ClCH2COOH |
+Cl2 |
Cl CHCOOH |
+Cl2 |
CCl COOH |
||
|
|
|
|
|||||
|
|
|
|
|
||||
|
|
-HCl |
|
-HCl |
2 |
-HCl |
3 |
|
|
|
|
|
|
||||
Особенности строения и свойства муравьиной кислоты Муравьиная (метановая) кислота НСООН по своему строению и свой-
ствам отличается от остальных предельных монокарбоновых кислот.
Муравьиная кислота проявляет общие свойства кислот, так как имеет функциональную карбоксильную группу. От остальных карбоновых кислот му-
равьиная кислота отличается тем, что карбоксильная группа в ней связана не с углеводородным радикалом, а с атомом водорода. Поэтому муравьиную кисло-
ту можно рассматривать и как кислоту, и как альдегид:
O
H C OH
Муравьиная кислота вступает и в реакции, характерные как для альдеги-
дов. Она легко окисляется до угольной кислоты: HCOOH + [O] → HOCOOH →CO2↑ + H2O
В качестве окислителей можно использовать аммиачный раствор оксида серебра (I) Ag2O и гидроксид меди (II) Cu(OH)2. Таким образом, для муравьиной кислоты характерны качественные реакции на альдегиды (реакция «сереб-
ряного зеркала» и реакция с гидроксидом меди (II).
71
vk.com/club152685050 | vk.com/id446425943
Специфическое свойство муравьиной кислоты – способность разлагаться на оксид углерода (II) и воду под действием H2SO4(конц):
H2SO4 K
HCOOH  CO + H2O
CO + H2O
Получение карбоновых кислот.
1. Общие способы получения:
- окисление первичных спиртов и альдегидов под действием различных окислителей:
|
|
|
-H2O |
|
O |
+[O] |
|
|
O |
|
|
|
CH2OH + [O] |
|
C |
|
|
C |
|||
R |
|
|
R |
|
|
R |
|
|||
|
|
|
|
|||||||
HOH
-окисление алканов кислородом воздуха (в присутствии Мn2+ или при нагревании под давлением). Обычно образуется смесь кислот. При окислении бутана единственным продуктом является уксусная кислота:
|
kat |
|
2CH3CH2CH2COOH + 5O2 |
|
4CH3COOH + H2O |
|
||
- омыление сложных эфиров (т. е. их щелочной гидролиз):
R |
|
C |
O |
|
|
|
C |
O |
|
+ HCl |
|
R |
|
+ NaCl |
|||
|
||||||||
|
|
|
||||||
|
|
|
ONa |
|
|
|
|
OH |
- гидролиз галогенангидридов кислот:
|
|
O |
|
|
|
|
|
|
O |
R |
|
C |
+ H2O |
|
R |
|
C |
+ HCl |
|
|
|
||||||||
|
|
|
|||||||
|
|
Cl |
|
|
|
|
|
|
OH |
|
|
2. Специфические способы получения кислот: |
|||||||
NaOH + CO |
to,P |
|
HCOONa |
|
|||||
|
|
||||||||
2HCOONa + H2SO4 → 2HCOOH + Na2SO4
ферменты
СН3–СН2ОН + O2 → СН3СООН + Н2O
CH OH + CO |
to, kat |
CH COOH |
|
||
3 |
|
3 |
3.9.1.4 Сложные эфиры
Сложные эфиры – это производные карбоновых кислот, в которых атом водорода карбоксильной группы замещён на алкильный радикал; или это про-
дукты замещения гидроксильного атома водорода в спиртах на кислотный радикал (ацил).
72

vk.com/club152685050 | vk.com/id446425943
Номенклатура. Названия сложных эфиров образуются из названий соот-
ветствующих кислот или кислотных остатков и названий алкильных радикалов, входящих в состав спиртов:
|
|
O |
|
|
|
O |
|||
H |
|
C |
CH3 |
|
C |
|
|
|
|
|
|
|
|
|
|||||
|
|
O |
|
CH3 |
O |
|
C5H11 |
||
|
|
|
|
||||||
метиловый эфир муравьиной кислоты |
|
амиловый эфир уксусной кислоты |
|||||||
(муравьинометиловый эфир, метилформиат) |
|
(уксусноамиловый эфир, амилацетат) |
|||||||
Изомерия: 1) углеродного скелета; 2) межклассовая (изомерны карбоновым кислотам); 3) оптическая.
Физические свойства. Простейшие по составу сложные эфиры карбоновых кислот – бесцветные легкокипящие жидкости с фруктовым запахом; выс-
шие сложные эфиры – воскообразные вещества (пчелиный воск), все сложные эфиры в воде растворяются плохо.
Химические свойства.
Гидролиз – важнейшее химическое свойство сложных эфиров:
|
|
O |
|
H |
|
|
, to |
|
|
|
O |
|
|
|
C |
|
|
|
|
|
C |
||||
C2H5 |
|
+ H2O |
|
|
|
|
C2H5 |
|
+ C2H5OH |
|||
|
|
|
|
|
||||||||
|
|
|||||||||||
|
|
|
|
|
||||||||
|
|
O |
|
C2H5 |
|
|
|
OH |
||||
|
|
|
|
|
|
|
||||||
этилпропионат
Для смещения реакции в сторону образования эфира можно «связать» образующуюся воду водоотнимающим средством (например, конц. H2SO4). В том случае, когда необходимо провести гидролиз эфира, реакцию иногда проводят в присутствии щёлочи, которая позволяет «связать» образующуюся кислоту.
3.9.2 Галогенпроизводные УВ Галогенпроизводные УВ – производные углеводородов, в молекулах ко-
торых один или несколько атомов водорода замещены атомами галогенов. Номенклатура: СН3Сl – хлорметан, СНСl3 – трихлорметан (хлороформ),
FСН2СН2F– 1,2-дифторэтан, СН3СНСlСН3 – 2-бромпропан и т. д.
Изомерия: 1) углеродного скелета; 2) положения функциональной груп-
пы; 3) оптическая.
Физические свойства галогенпроизводных зависят от природы галогена, от величины и строения радикала. Первые четыре члена фтропроизводных, два хлорпроизводных и бромметан – газы, остальные – жидкости, высшие галогенпроизводные УВ – твёрдые вещества.
Химические свойства. Галогеналканы – один из наиболее реакционноспособных классов органических соединений. С их помощью вводят в различ-
73
