- •1. Квантовые числа.
- •2.Принцип Паули, правило Гунда, правило Клечковского, принцип наименьшей энергии.
- •5. Химическая связь. Виды химических связей.
- •6. Метод валентных связей. Свойства ковалентной связи. Насыщаемость, направленность, поляризуемость.
- •Метод валентных связей.
- •7. Метод молекулярных орбиталей. Связывающие и разрыхляющие орбитали. Порядок связи.
- •8.Основные термодинамические понятия: система, параметры и функции состояния. Внутренняя энергия. Энтальпия.
- •10. Закон Гесса. Тепловые эффекты химических реакций. Примеры расчетов.
- •11. Энтропия как функция состояния. Изменение энтропии в химических реакциях.
- •Изменение энтропии.
- •14. Свободная энергия Гиббса. Условия самопроизвольного протекания процессов в изобарно-изотермических условиях.
- •15.Энергия Гельмгольца. Условия самопроизвольного протекания процессов в изохорно-изотермических условиях.
- •16.Скорость химической реакции. Факторы, влияющие на скорость реакции.
- •17. Константа скорости химической реакции. Простые и сложные реакции. Порядок и молекулярность реакций.
- •Одностадийные реакции.
- •Сложные химические реакции.
- •19. Теория активных молекул. Энергия активации. Теория активированного комплекса.
- •21.Каталитические реакции. Гомогенный и гетерогенный катализ.
- •22. Условия химического равновесия. Константа химического равновесия для гомогенных и гетерогенных систем.
- •23. Химическое равновесие(см пред).Принцип Ле-Шателье.
- •24.Криоскопия и эбулиоскопия.
- •25. Растворы. Химическое равновесие в растворах электролитов.
- •28. Дисперсные системы. Основные виды дисперсных систем.
- •29. Коллоиды. Строение мицеллы.
- •30. Коагуляция и пептизация. Роль электролитов и пав.
- •31. Окислительно-восстановительные реакции. Направление их протекания . Red-ox потенциалы.
- •32. Скачок потенциала на границе «металл-раствор». Равновесные потенциалы. Стандартные потенциалы. Ряд стандартных электронных потенциалов.
- •33. Теория гальванического элемента. Эдс. Связь эдс с энергией Гиббса.
- •34 .Стандартный водородный электрод. Зависимость потенциала водородного электрода от рН раствора.
- •35. Электроды первого рода. Стандартные электродные потенциалы металлов. Уравнеиние Нернста.
- •Уравнение Нернста.
- •38. Поляризация в гальваническом элементе. Типы поляризации. Причины возникновения и способы ее устранения.
- •39. Электрохимическая коррозия. Коррозия с водородной и кислородной деполяризацией.
- •Коррозия с водородной и кислородной деполяризацией.
- •42. Электролиз. Анодное окисление и катодное восстановление. Последовательность разряда ионов.
- •43. Концентрационная и химическая поляризация. Явление перенапржения. Потенциал разложения электролита.
- •44. Электролиз с растворимым и нерастворимым анодом.
- •45. Методы очистки металлов. Электрохимическое рафинирование.
- •46. Правило фаз Гиббса. Диаграммы состояния одно- и двухкомпонентных систем.
- •47. Элементы термического анализа.
14. Свободная энергия Гиббса. Условия самопроизвольного протекания процессов в изобарно-изотермических условиях.
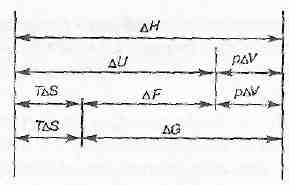
Разность (H-TΔS) называют энергией Гиббса системы и обозначают буквой ΔG. Энергия Гиббса термодинамическая функция состояния системы. Изменение энергии Гиббса
ΔG=ΔH-TΔS. (5.13)
Энергия Гиббса химической реакции характеризует направление и предел самопроизвольного протекания реакции в условиях постоянства температуры и давления. В изобарно-изотермических – идет если G<= 0.
Как видно, тепловой эффект химической реакции включает в себя две части. Первая часть (первый член этого уравнения) ΔG равна максимальной работе Wрмах, которую может совершить система при равновесном проведении процесса в изобарно-изотермических условиях. Следовательно, изменение энергии Гиббса реакции - это часть энергетического эффекта химической реакции, которую можно превратить в работу:
-ΔGт=Wрмах (5.14)
Поскольку изменение энергии Гиббса реакции можно превратить в работу, то ее также называют свободной энергией.
Второй член правой части уравнения (энтропийный фактор) представляет собой часть энергетического эффекта, которую можно превратить в теплоту, рассеивающуюся в окружающую среду. Поэтому энтропийный фактор TΔS называют связанной энергией.
Изменение энергии Гиббса служит критерием самопроизвольного протекания химической реакции при изобарно-изотермиче-ских процессах. Химическая реакция принципиально возможна, если энергия Гиббса (системы) уменьшается, т.е.
ΔG<0. (5.15)
Уравнение (5.15) является условием возможности самопроизвольного течения реакции в прямом направлении.
Химическая реакция не может протекать самопроизвольно, если энергия Гиббса системы возрастает, т.е.
ΔG>0. (5.16)
Уравнение (5.16) является условием невозможности самопроизвольного течения реакции в прямом направлении. Это же уравнение служит термодинамическим условием возможности самопроизвольного протекания обратной реакции. Наконец, если
ΔG=0, (5.17)
то реакция может протекать как в прямом, так и в обратном направлениях, т.е. реакция обратима.
15.Энергия Гельмгольца. Условия самопроизвольного протекания процессов в изохорно-изотермических условиях.
Разность (U-TS) называют энергией Гельмгольца системы и обозначают F. Энергия Гельмгольца также является термодинамической функцией состояния системы. Изменение энергии Гельмгольца ΔF=ΔU-TΔS.
DeltaF характеризует направление и предел самопроизвольного течения реакции в изохорно-изотермических условиях.
Условия: В изохорно-изотермических – идет если F<= 0
Максимальная работа Wνмах, которую может совершить система при равновесном поведении процесса в изохорно-изотермических условиях, равна Энергии Гельмгольца системы ΔF:
Wνмах=- ΔFт
Изменение энергии Гельмгольца равно:
ΔF=ΔU-TΔS
Изменение энергии Гельмогольца характеризует направление и предел самопроизвольного течения химической реакции при изохорно-изотермических условиях, которое возможно при соблюдении неравенства
ΔF<0.
Соотношение между термодина мическими функциями состояниясистемы представлено на рис. 5.4.