
- •6. Квантовые числа
- •7.Типы атомных орбиталей.
- •8. Распределение электронов в атоме
- •12. Электронные конфигурации атомов и ионов.
- •13. Периодический закон д. И. Менделеева.
- •15. Структура периодической системы: период, ряд, группа и подгруппа.
- •17. Энергия ионизации, сродство к электрону, электроотрицательность Энергия ионизации
- •Сродство атома к электрону
- •Электроотрицательность
- •19.Механизм образования ковалентной связи. Обменный и донорно-акцепторный механизм образования ковалентной связи.
- •20 Метод валентных связей
- •21 Свойства ковалентной связи
- •22. Гибридизация атомных орбиталей, геометрическая структура молекул.
- •23. Ковалентная связь полярная и неполярная
- •24. Полярность молекул.
- •25. И 26 ионная связь. Ионная химическая связь
- •28. Окислительно- восстановительные процессы.
- •29. 30 Окислители и восстановители.
- •33Основные термодинамические понятия: система, гомогенная и гетерогенная система, изолированная закрытая система, система открытая, параметры состояния системы, термодинамические функции.
- •34 Внутренняя энергия и энтальпия
- •36 Эндотермические и экзотермические процессы.
- •37 Закон Гесса и следствия вытекающие из него Закон Гесса
- •Следствия закона Гесса
- •38 Стандартная энтальпия образования сложного вещества.
- •39Тепловой эффект реакции
- •40 41 Энтропия и изобарно-изотермический потенциал.
- •42 Химическая кинетика.
- •43 Скорость химических реакций
- •44.45 Энергия активации. Уравнение Аррениуса Уравнение Аррениуса
- •46 Зависимость скорости реакции от концентрации реагирующих веществ и давления.
- •47 Закон действующих масс
- •48 И 49 кинетическое уравнение. Константа скорости реакции.
- •50.Влияние темпер. На скорость хим реакции, правило Вант-Гоффа. Влияние температуры на константу скорости реакции
- •51 52. Влияние катализатора на скорость реакции. Катализ
- •53, 54 И 55 Процессы обратимые и необратимые. Химическое равновесие. Константа химического равновесия.
- •56 И 57. Принцип Ле- Шателье. Влияние темпер, концентрации, давления и катализатора на смещение равновесия
- •58 Общая характеристика растворов .
- •59 Способы выражения концентрации растворов
- •60 Молярная, моляльная концентрация, массовая доля, молярная концентрация эквивалентов.
- •61 И 62 давление пара растворов. Закон Рауля для растворов неэлектролитов. Замерзание и кипение растворов
- •63 И 64 Понижение температуры замерзания и повышение температуры кипения раствора. Криоскопия и эбуллиоскопия.
- •65 И 66 осмос, осмотическое давление. Закон вант-Гоффа. Осмотическое давление
- •67 Теория электролитической диссоциации Аррениуса.
- •69Степень и константы диссоциации
- •68 Электролиты сильные и слабые.
- •70 Электролитическая диссоциация сильных и слабых электролитов: кислот, оснований, солей в воде
- •71 Ступенчатая диссоциация.
- •72 Ионные реакции. 73 условия течения реакций обмена в растворах электролитах.
- •74 Электролитическая диссоциация воды. Ионно-молекулярные равновесия
- •Правила составления уравнений ионно-молекулярных реакций
- •75 Ионное произведение воды(kw) 77 pH кислот и оснований. Кислотно-основные равновесия. Водородный показатель рН
- •76 Водородный показатель pH как мера кислотности и щелочности среды.
- •78Понятия об индикаторах.
- •79 Окраска индикаторов в различных средах.
- •80 Гидролиз солей
- •81 Соли гидролизующиеся по аниону катиону, не гидролизирующиеся соли.
- •82 Изменение пш среды при гидролизе.
- •83 Влияние внешних факторов на степень полноты гидролиза
- •84 Электродный потенциал, механизм его возникновения.
- •85 Уравнение Нернста. Уравнение Нернста
- •86 Электрохимический ряд напряжений металлов.
- •87 Типы электродов
- •Механизм возникновения электродных потенциалов и определение их величин
- •88 Гальванические элементы. 90 поляризация
- •89 Измерение электродвижущей силы.
- •91 Химические источники тока: аккумуляторы, топливные элементы.
- •92 Коррозия металлов.
- •93 Виды коррозии.
- •Химическая коррозия
- •94 Механизм Электрохимической коррозии Электрохимическая коррозия
- •95.Защита металлов от коррозии
- •Защита металлов на стадии проектирования
- •Защита от коррозии на стадии изготовления
- •Защита от коррозии на стадии эксплуатации
- •Защита путём уменьшения агрессивности среды
- •97 Аналитический сигнал
- •98. Основы качественного и количественного анализа.
- •Количественный химический анализ
- •99 Качественные реакции на ионы
II
4. Отказ от классического представления об атомах произошел в 1897 г., когда Дж. Томсоном был открыт электрон – отрицательно заряженная частица, входящая в состав всех атомов. Поскольку электрон имеет отрицательный заряд, а атом в целом электронейтрален, было сделано предположение, что в нем должна быть ещё и положительная частица. С помощью Опыта Э. Резерфорда, было открыто атомное ядро – положительно заряженная микрочастица, которая намного меньше атома, но в ней почти полностью сосредоточена его масса.
в 1900 году М. Планкпредположил, что излучение энергии (Е) в этом случае происходит не непрерывно, а определенными порциями – квантами. Математически представил это в виде уравнения (уравнение Планка):
E = h∙, (1.1)
где - частота света, h – универсальная постоянная (постоянная Планка), характеризующая меру дискретной порции энергии, которой обмениваются вещество и излучение.
Так, в 1905 г. А. Эйнштейн ввел понятие кванта света и использовал его для объяснения фотоэффекта. При этом было доказано, что свет обладает одновременно и корпускулярными, и волновыми свойствами. Так появилось понятие о корпускулярно-волновом дуализме, позже распространенном на весь микромир. Это был революционный шаг – признать, что свет распространяется как волна, но излучает и поглощает как частица.
В 1913 г. Н. Бор применил идею кванта для решения вопроса о строении атома, уточнив планетарную модель атома Резерфорда. Бор показал, что система атома существует на основе электромагнитных сил, а не гравитационных, как считал Резерфорд. Также в каждом атоме существует несколько стационарных орбит электронов, двигаясь по которым, они не излучают энергии. Лишь при переходе электрона из одного стационарного состояния в другое атом излучает или поглощает энергию.
электрон, тоже обладает волновой природой. Поэтому электрон – не шарик, не точка, он обладает внутренней структурой, которая до сих пор не известна. В действительности электроны как бы «размазаны» по атому, образуя электронное облако.
Следующий
шаг в создании новой теории был сделан
Луи
де Бройлем, выдвинувшим в 1924 г. гипотезу
о волновых свойствах материи.
Он довел идею кванта до логического
конца и утверждал, что волновые свойства
присущи не только квантам света и
электронам, но и протонам, атомам,
молекулам и даже макроскопическим
телам. Длина волны определяется формулой
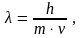 (1.2)
(1.2)
где - частота света, h – универсальная постоянная (постоянная Планка), характеризующая меру дискретной порции энергии, которой обмениваются вещество и излучение, - длина волны света, m – масса вещества.
5. Для характеристики состоянияэлектрона была предложена комплексная волновая функция. Зная её можно вычислить вероятность обнаружения определенного значения не только координаты, но и любой другой физической величины. Эволюция состояния системы определяется именно с помощью уравнения Шрёдингера.
2 + 2m0/ħ2 ∙ (E – U) ∙ = 0 или Ĥ = Е , (1.3)
где - комплексная волновая функция, Ĥ – квантово-механический оператор полной энергии Гамильтона, который учитывает движение электрона в пространстве, Е – энергия электрона в атоме.
Для того, чтобы определить энергетическое состояние электрона в атоме решают уравнение Шрёдингера, которое кроме массы электрона, его заряда энергии кинетического движения входит некоторая функция (пси), которая характеризует волновые свойства электрона. Математическое решение этого уравнения, представлено в виде функции, зависящей от 4 квантовых чисел, которые и характеризуют положение электрона в около ядерном пространстве.
6. Квантовые числа
n – главное квантовое число, оно показывает энергию электрона, находящегося на данном энергетическом уровне. Принимает значения 1, 2, 3, 4…7. Чем ближе к ядру уровень, тем меньше энергия уровня.
l – орбитальное квантовое число. Оно показывает форму электронного облака. Принимает значения от 0 до n – 1.
Если l=0, то это s облачко, оно имеет форму сферы;
если l=1, то это р облачко, оно имеет форму гантели;
если l=2, то это d облачко, оно имеет форму сдвоенной гантели;
если l=3, то это fоблачко, оно имеет форму сложного лепестка.
В нормальном состоянии у электрона нет других форм облаков.
ml – магнитное квантовое число, показывает ориентацию электронных облаков около ядерного пространства. Принимают значения от – l, …0… + l.
Если l=0, то ml = 0;
еслиl=1, то ml = −1, 0, 1;
еслиl=2, то ml = −2, −1, 0, 1, 2;
еслиl=3, то ml = −3, −2, −1, 0, 1, 2, 3.
ms – спиновое квантовое число, характеризует собственный момент движения электрона. Принимает значения: + ½ и − ½.
7.Типы атомных орбиталей.
Для элементов 1-го периода (Н, He) характерна одна АО - 1s. (1 клеточка)
Р( 3 клеточки) у d( 5 клеточек)
В элементах 2-го периода электроны занимают пять АО на двух энергетических уровнях: первый уровень 1s; второй уровень - 2s, 2px, 2py, 2pz. (цифры обозначают номер энергетического уровня, буквы - форму орбитали).
Состояние электрона в атоме полностью описывают квантовые числа.
8. Распределение электронов в атоме
От распределения электронов в атоме зависят химические свойства элементов. По электронным формулам можно определить свойства элемента. Распределяются электроны в атоме согласно четырем принципам:
∙ принцип наименьшей энергии;
∙ правило Клечковского;
∙ принцип Паули;
∙ правило Гунда.
Принцип наименьшей энергии. Любая система, в том числе и микрочастицы, в том числе и электроны, стремятся занять положение, более энергетически выгодное, т.е. с наименьшей энергией. Сначала заполняется 1-й энергетический уровень, затем 2-й энергетический уровень и т.д.
9. Последовательность заполнения электронами орбиталей осуществляется в соответствии с принципом минимальной энергии, согласно которому электроны заполняют орбитали в порядке повышения уровня энергии орбиталей. Очередность орбиталей по энергии определяется правилом Клечковского: увеличение энергии и соответственно заполнение орбиталей происходит в порядке возрастания суммы (n+l), а при равной сумме (n+l) – в порядке возрастания n.
10. Правило Клечковского. Увеличение энергии и соответственно заполнение орбиталей происходит в порядке возрастания суммы квантовых чисел n + l, а при равной сумме n + l в порядке возрастания числа n. Соответственно этому правилу подоболочки выстраиваются в следующий ряд:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 5d …
11. Принцип Паули гласит, что в атоме не может быть двух одинаковых электронов, со всеми одинаковыми четырьмя квантовыми числами, хотя бы одним квантовым числом они должны отличаться.
Правило Гунда. Электроны на эквивалентных орбиталях располагаются так, чтобы суммарный спин их был максимальный.Орбиталь обозначаем , а спин электрона: (+1/2), (-1/2).
Количество электронов на данном уровне можно определить по формуле 2 n2, но эта формула справедлива только до 4-го энергетического уровня, на остальных уровнях больше 32 ē быть не может.
