
- •6. Квантовые числа
- •7.Типы атомных орбиталей.
- •8. Распределение электронов в атоме
- •12. Электронные конфигурации атомов и ионов.
- •13. Периодический закон д. И. Менделеева.
- •15. Структура периодической системы: период, ряд, группа и подгруппа.
- •17. Энергия ионизации, сродство к электрону, электроотрицательность Энергия ионизации
- •Сродство атома к электрону
- •Электроотрицательность
- •19.Механизм образования ковалентной связи. Обменный и донорно-акцепторный механизм образования ковалентной связи.
- •20 Метод валентных связей
- •21 Свойства ковалентной связи
- •22. Гибридизация атомных орбиталей, геометрическая структура молекул.
- •23. Ковалентная связь полярная и неполярная
- •24. Полярность молекул.
- •25. И 26 ионная связь. Ионная химическая связь
- •28. Окислительно- восстановительные процессы.
- •29. 30 Окислители и восстановители.
- •33Основные термодинамические понятия: система, гомогенная и гетерогенная система, изолированная закрытая система, система открытая, параметры состояния системы, термодинамические функции.
- •34 Внутренняя энергия и энтальпия
- •36 Эндотермические и экзотермические процессы.
- •37 Закон Гесса и следствия вытекающие из него Закон Гесса
- •Следствия закона Гесса
- •38 Стандартная энтальпия образования сложного вещества.
- •39Тепловой эффект реакции
- •40 41 Энтропия и изобарно-изотермический потенциал.
- •42 Химическая кинетика.
- •43 Скорость химических реакций
- •44.45 Энергия активации. Уравнение Аррениуса Уравнение Аррениуса
- •46 Зависимость скорости реакции от концентрации реагирующих веществ и давления.
- •47 Закон действующих масс
- •48 И 49 кинетическое уравнение. Константа скорости реакции.
- •50.Влияние темпер. На скорость хим реакции, правило Вант-Гоффа. Влияние температуры на константу скорости реакции
- •51 52. Влияние катализатора на скорость реакции. Катализ
- •53, 54 И 55 Процессы обратимые и необратимые. Химическое равновесие. Константа химического равновесия.
- •56 И 57. Принцип Ле- Шателье. Влияние темпер, концентрации, давления и катализатора на смещение равновесия
- •58 Общая характеристика растворов .
- •59 Способы выражения концентрации растворов
- •60 Молярная, моляльная концентрация, массовая доля, молярная концентрация эквивалентов.
- •61 И 62 давление пара растворов. Закон Рауля для растворов неэлектролитов. Замерзание и кипение растворов
- •63 И 64 Понижение температуры замерзания и повышение температуры кипения раствора. Криоскопия и эбуллиоскопия.
- •65 И 66 осмос, осмотическое давление. Закон вант-Гоффа. Осмотическое давление
- •67 Теория электролитической диссоциации Аррениуса.
- •69Степень и константы диссоциации
- •68 Электролиты сильные и слабые.
- •70 Электролитическая диссоциация сильных и слабых электролитов: кислот, оснований, солей в воде
- •71 Ступенчатая диссоциация.
- •72 Ионные реакции. 73 условия течения реакций обмена в растворах электролитах.
- •74 Электролитическая диссоциация воды. Ионно-молекулярные равновесия
- •Правила составления уравнений ионно-молекулярных реакций
- •75 Ионное произведение воды(kw) 77 pH кислот и оснований. Кислотно-основные равновесия. Водородный показатель рН
- •76 Водородный показатель pH как мера кислотности и щелочности среды.
- •78Понятия об индикаторах.
- •79 Окраска индикаторов в различных средах.
- •80 Гидролиз солей
- •81 Соли гидролизующиеся по аниону катиону, не гидролизирующиеся соли.
- •82 Изменение пш среды при гидролизе.
- •83 Влияние внешних факторов на степень полноты гидролиза
- •84 Электродный потенциал, механизм его возникновения.
- •85 Уравнение Нернста. Уравнение Нернста
- •86 Электрохимический ряд напряжений металлов.
- •87 Типы электродов
- •Механизм возникновения электродных потенциалов и определение их величин
- •88 Гальванические элементы. 90 поляризация
- •89 Измерение электродвижущей силы.
- •91 Химические источники тока: аккумуляторы, топливные элементы.
- •92 Коррозия металлов.
- •93 Виды коррозии.
- •Химическая коррозия
- •94 Механизм Электрохимической коррозии Электрохимическая коррозия
- •95.Защита металлов от коррозии
- •Защита металлов на стадии проектирования
- •Защита от коррозии на стадии изготовления
- •Защита от коррозии на стадии эксплуатации
- •Защита путём уменьшения агрессивности среды
- •97 Аналитический сигнал
- •98. Основы качественного и количественного анализа.
- •Количественный химический анализ
- •99 Качественные реакции на ионы
12. Электронные конфигурации атомов и ионов.
Краткую запись распределения электронов в атоме по различным электронным оболочкам атома с учётом их главного и орбитального квантовых чисел n и l называют электронной конфигурацией атома.
III
13. Периодический закон д. И. Менделеева.
Современная формулировка закона Д.И. Менделеева: «Свойства элементов, а также свойства образованных ими соединений находятся в периодической зависимости от заряда ядра атома».
Физический смысл Периодического закона заключается в периодическом изменении свойств элементов в результате периодически возобновляющихся сходных электронных оболочек атомов при последовательном возрастании значений главного квантового числа.
14. Периодическая система Д. И. Менделеева как естественная классификация элементов.
Физическая основа периодического закона была установлена в 1922 г. Н. Бором. Поскольку химические свойства обусловлены строением электронных оболочек атома, периодическая система Менделеева – это естественная классификация элементов по электронным структурам их атомов. Простейшая основа такой классификации – число электронов в нейтральном атоме, которое равно заряду ядра. Но при образовании химической связи электроны могут перераспределяться между атомами, а заряд ядра остается неизменным, поэтому современная формулировка периодического закона гласит: «Свойства элементов находятся в периодической зависимости от зарядов ядер их атомов».
15. Структура периодической системы: период, ряд, группа и подгруппа.
Рассмотрим строение ПС. В таблице находится 7 периодов, 8 групп. Причем каждая группа, кроме 8-ой делиться на подгруппы. К главной подгруппе относятся элементы 1, 2, 3-го периода и все элементы, расположенные под ними, а остальные − это побочная подгруппа. В подгруппах находятся электронные аналоги, т.е. они имеют одинаковое строение внешних электронных энергетических слоев. Так элементы 1-ой и 2-ой групп относятся к s-элементам. Элементы остальных групп, главных подгрупп – это элементы р-семейств, а все элементы побочных подгрупп – это элементы d-семейств. Лантаноиды и актиноиды (f– элементы) находятся в III подгруппе в соответствии с особенностями их электронной конфигурации.
Структура электронной оболочки атомов химических элементов изменяется периодически с ростом порядкового номера элемента. Поскольку свойства есть функция строения электронной оболочки, они должны находиться в периодической зависимости от заряда ядра атома. Объясняется это тем, что периодичность присуща всей электронной оболочке атомов, а не только её внешним слоям.
17. Энергия ионизации, сродство к электрону, электроотрицательность Энергия ионизации
Элементы, которые вступая во взаимодействие, отдают электроны на образование химической связи, обладают восстановительными свойствами и мерой их восстановительной способности является потенциал ионизации. Потенциал ионизации – это энергия, которую нужно затратить, чтобы «отнять» электрон от атома. Размерность эВ.эВ рассчитывают на 1 – электрон, если нужно отнять 2 электрона, то затрачивают в два раза больше энергии. Энергия ионизации (измеряется в кДж/моль или эВ) возрастает по периоду. Наименьшее значение энергии ионизации имеют щелочные металлы, находящиеся в начале периода, наибольшими значениями энергии ионизации характеризуются благородные газы, находящиеся в конце периода (рис.1.2).
Рис. 1.1. Зависимость эффективных радиусов атомов от порядкового номера элемента
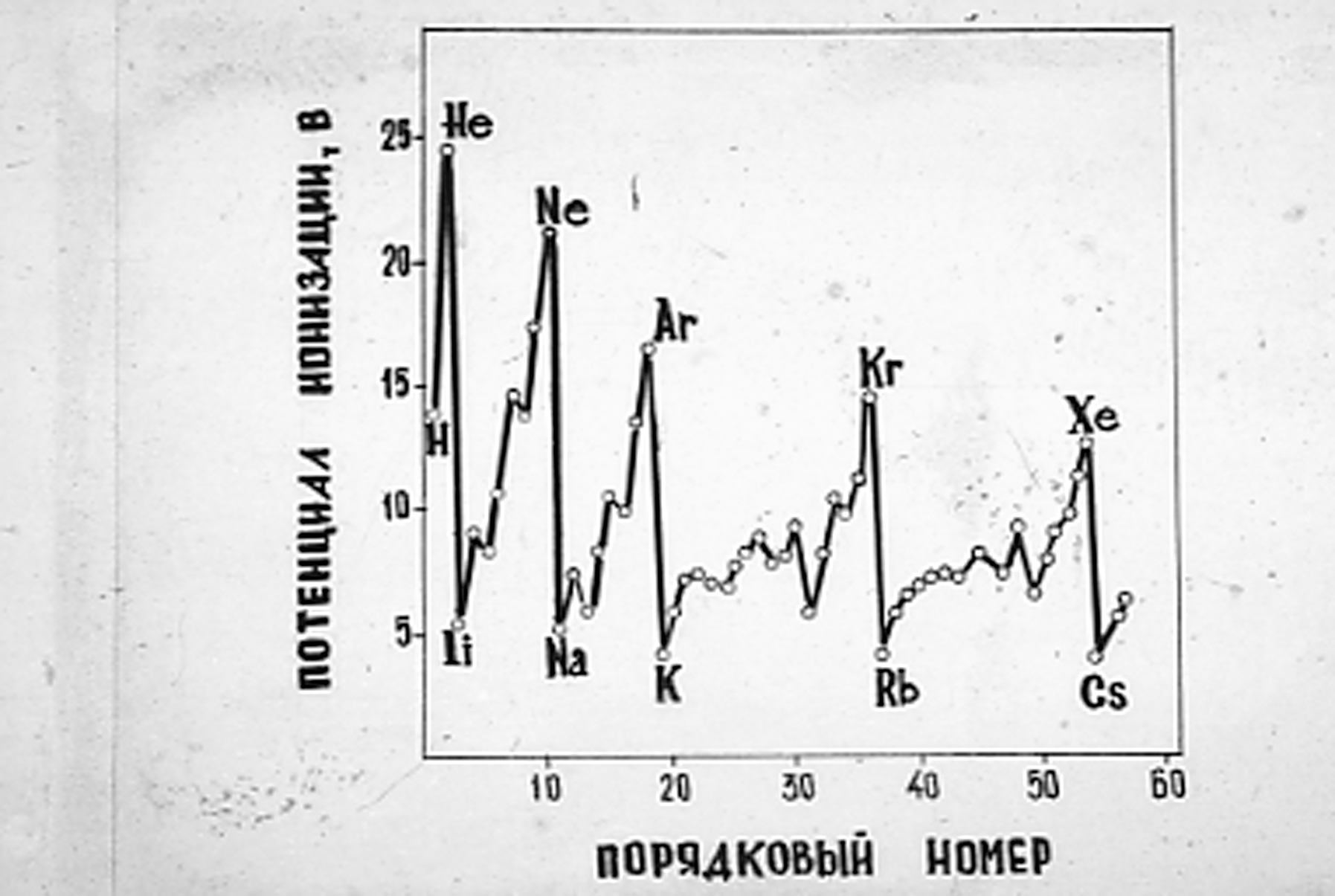
Рис. 1.2. Зависимость ионизационных потенциалов атомов
от порядкового номера элемента
Пики на кривой зависимости энергии ионизации от порядкового номера элемента наблюдаются у элементов с законченной s-подоболочкой (Ве, Мg) и d-подоболочкой (Zn, Cd, Hg) и р-подоболочкой, в АО которой находится по три электрона (N, P, As). Минимумы на кривой наблюдаются у элементов, имеющих на внешней подоболочке по одному электрону (щелочные металлы, В, Al, Ga, In).
В одной и той же группе энергия ионизации несколько уменьшается с увеличением порядкового номера элемента, что обусловлено увеличением размеров атома и расстояния внешних подоболочек от ядра.
