
СВОЙСТВА БЛАГОРОДНЫХ МЕТАЛЛОВ.
Название и содержание в земной коре(%) |
Символ |
Атомный номер |
Наружные электроны атома |
Относительная атомная масса |
Изотопный состав |
Плотность г/см3 |
Т пл |
Ткип |
Степени окисления |
Серебро (Argentum) 1·10-5 |
Ag |
47 |
4d105s1 |
107,8680 |
107(51,35%) 109(48,65%) |
10,50 |
960,50 |
2212 |
1 |
Золото (Aurum) 5·10-7 |
Au |
79 |
5d106s1 |
196,9665 |
197(100%) |
19,32 |
1064,4 |
2941 |
1,2,3 |
Рутений (Ruthenium) 5·10-7 |
Ru |
44 |
4d75s1 |
101,7 |
7 изотопов |
12,4 |
2250 |
4900 |
от 1 до 8 |
Родий (Rhodium) 1·10-7 |
Rh |
45 |
4d85s1 |
102,9055 |
103(100%) |
12,44 |
1960 |
4500 |
2,3,4 |
Палладий (Palladium) 1·10-6 |
Pd |
46 |
4d10 |
106,4 |
6 изотопов |
12,02 |
1552 |
3980 |
2,3,4 |
Осмий (Osmium) 5·10-6 |
Os |
76 |
5d66s2 |
190,2 |
7 изотопов |
22,5 |
3050 |
5500 |
2,3,4,6,8 |
Иридий (Iridium) 1·10-7 |
Ir |
77 |
5d76s2 |
192,22 |
191(38,5%) 193(61,5%) |
22,4 |
2410 |
5300 |
1,2,3,4,6 |
Платина (Platinum) 5·10-7 |
Pt |
78 |
5d96s1 |
195,09 |
6 изотопов |
21,45 |
1769 |
4530 |
2,3,4 |
Водородный показатель (рН) величина,
характеризующая активность или
концентрацию ионов водорода в растворах.
Водородный показатель обозначается
рН.
Водородный показатель численно
равен отрицательному десятичному
логарифму активности или концентрации
ионов водорода, выраженной в молях на
литр:
pH=-lg[ H+ ]
В воде концентрация
ионов водорода определяется
электролитической диссоциацией воды
по уравнению
H2O=H++OH-
Константа диссоциации при 22° С
составляет
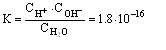 Пренебрегая
незначительной долей распавшихся
молекул, можно концентрацию
недиссоциированной части воды принять
равной обшей концентрации воды, которая
составляет: С[H2O
]=1000/18=55,55моль/л.
Тогда:
Пренебрегая
незначительной долей распавшихся
молекул, можно концентрацию
недиссоциированной части воды принять
равной обшей концентрации воды, которая
составляет: С[H2O
]=1000/18=55,55моль/л.
Тогда:
C[ H+ ] ·C[ OH-
]=K·C[H2O]=1,8·10-16·55,55=10-14
Для
воды и ее растворов произведение
концентраций ионов Н+ и ОН- величина
постоянная при данной температуре. Она
называется ионным произведением воды
КВ и при 25° С составляет
10-14.
Постоянство ионного
произведения воды дает возможность
вычислить концентрацию ионов H+если
известна концентрация ионов OH-
и
наоборот:
![]() .
Понятия
кислая, нейтральная и щелочная среда
приобретают количественный смысл.
В
случае, если [ H+ ] =[ OH- ]эти
концентрации (каждая из них) равны
.
Понятия
кислая, нейтральная и щелочная среда
приобретают количественный смысл.
В
случае, если [ H+ ] =[ OH- ]эти
концентрации (каждая из них) равны
![]() моль/л,
т.е [ H+ ] =[ OH- ]=10-7моль/л
и среда нейтральная, в этих растворах
pH=-lg[ H+ ]=7 и рОН=-lg[ OH-]=7
Если
[ H+ ]>10-7моль/л, [ OH-]<10-7моль/л
-среда кислая; рН<7.
Если [ H+
]<10-7 моль/л, [ OH-]>10-7моль/л
-среда щелочная; рН>7.
В любом водном
растворе рН + рОН =14, где рОН=-lg[ OH-]
Величина
рН имеет большое значение для биохимических
процессов, для различных производственных
процессов, при изучении свойств природных
вод и возможности их применения и т.д.
моль/л,
т.е [ H+ ] =[ OH- ]=10-7моль/л
и среда нейтральная, в этих растворах
pH=-lg[ H+ ]=7 и рОН=-lg[ OH-]=7
Если
[ H+ ]>10-7моль/л, [ OH-]<10-7моль/л
-среда кислая; рН<7.
Если [ H+
]<10-7 моль/л, [ OH-]>10-7моль/л
-среда щелочная; рН>7.
В любом водном
растворе рН + рОН =14, где рОН=-lg[ OH-]
Величина
рН имеет большое значение для биохимических
процессов, для различных производственных
процессов, при изучении свойств природных
вод и возможности их применения и т.д.
Вычисление рН растворов кислот и оснований.
Для вычисления рН растворов кислот и оснований следует предварительно вычислить молярную концентрацию свободных ионов водорода ( ) или свободных гидроксил ионов ( ), а затем воспользоваться формулами: pH=-lg[ H+ ]; рОН-=-lg[ OH-]; рН + рОН =14 Концентрация любого иона в моль/л в растворе электролита можно вычислить по уравнению
![]()
где См иона – молярная концентрация иона в моль/л; См – молярная концентрация электролита в моль/л; α-степень диссоциации электролита; n -количество ионов данного вида, которое получается при распаде одной молекулы электролита. Если электролит слабый, то значение степени диссоциации может быть определено на основании закона разбавления Оствальда:
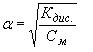
тогда CMиона=См·α·n =v СMКдис
Пример 1. Вычислить рН 0,001H раствора гидроксида натрия.
Решение: гидроксид натрия является
сильным электролитом, диссоциация в
водном растворе происходит по схеме:
NaOH
—>Na++OH-
Степень диссоциации
в разбавленном растворе можно принять
равной 1. Концентрация ионов ОН (моль/л)
в растворе равна:

Пример 2. Вычислить рН 1%-ного раствора муравьиной кислоты, считая, что плотность раствора равна 1г/мл; Кдисс = 2,1·10-4
Решение: 1л раствора содержит 10г НСООН, что составляет 10/46= =0,22моль, где 4б г/моль - молярная масса муравьиной кислоты. Следовательно, молярная концентрация раствора равна 0,22моль/л. Муравьиная кислота – слабый электролит, поэтому
![]() так
как HCOOH <—>H++HCOO-
так
как HCOOH <—>H++HCOO-
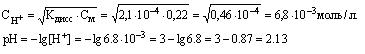 Пример
3. рН раствора составляет 4,3. Вычислить
[ H+ ] и [ OH- ]
Решение:
[Н+] = 10-pH =10-4,3 = 5•10-5моль/л
Пример
3. рН раствора составляет 4,3. Вычислить
[ H+ ] и [ OH- ]
Решение:
[Н+] = 10-pH =10-4,3 = 5•10-5моль/л
[ OH- ]=10-14/5•10-5=2•10-10моль/л.
Реакция водного раствора зависит не только от наличия в нем кислот или оснований, но также и от присутствия некоторых солей. Многие соли, растворяясь в воде, способны смещать реакцию среды в ту или иную сторону. При этом происходит химическое взаимодействие между ионами соли и молекулами воды, сопровождающееся образованием слабых кислот или слабых оснований или малодиссоциируемых ионов. Эта реакция получила название гидролиза солей. Гидролиз соли - это обратимый, обменный процесс взаимодействия ионов соли с водой, приводящий к образованию слабых электролитов. В результате гидролиза изменяется кислотность среды. Рассмотрим наиболее типичные случаи гидролиза солей. 1. Соль, образованная слабым основанием и сильной кислотой (гидролиз по катиону).
NH4Cl+HOH<—>NH4OH+HCl
NH4+ +Cl-+HOH<—>NH4OH+H++ Cl-
NH4+ +HOH<—>NH4OH+H+
В растворе накапливаются ионы H+, в результате чего реакция смещается в кислую сторону, рН в растворах солей подобного типа меньше7.
2. Соль, образованная сильным основанием и слабой кислотой (гидролиз по аниону).
CH3COONa+HOH<—>CH3COOH+NaOH
CH3COO-+Na++HOH<—>CH3COOH+Na++OH-
CH3COO-+HOH<—>CH3COOH+OH- В данном случае гидролиз ведет к увеличению концентраций ионов в растворе, среда щелочная, рН>7.
3. Соль, образованная слабой кислотой и слабым основанием (гидролиз по катиону и по аниону).
CH3COONH4 +HOH<—>CH3COOH+NH4OH
CH3COO- + NH4+ +HOH<—>CH3COOH+NH4OH
В результате гидролиза ацетата аммония происходит образование двух слабых электролитов, раствор оказывается близким к нейтральному, рН~7.
4. Соль, образованная сильным основанием и сильной кислотой.
Соли подобного типа гидролизу не подвергаются. Их ионы не образуют с ионами H+ и OH-воды слабодиссоциируюших или труднорастворимых соединений, равновесие между ионами и молекулами воды не нарушается и раствор остается нейтральным, рН равен 7.
Вычисление pH растворов солей
В качестве примера возьмем гидролиз ацетата натрия: CH3COONa+HOH<—>CH3COOH+NaOH Ионное уравнение: CH3COO-+HOH<—>CH3COOH+OH- Константа равновесия этой реакции
K=[CH3COOH]•[OH-]/[CH3COO- ]•[HOH] так как концентрация воды практически остается постоянной, ее можно объединить с константой равновесия:
Kг=K•[H2O]=[CH3COOH]•[OH-]/[CH3COO-] где Кг - константа гидролиза. Выразим [OH-] через ионное произведение воды [OH-] =Kв / [H+] и подставив эту величину в уравнение Кг получаем Kг=K•Kв =[CH3COOH]•[OH-]/[CH3COO-]•[H+] =Kв/Kk где Kk - константа диссоциации слабой кислоты. В общем случае, если исходную концентрацию аниона слабой кислоты А- -обозначить через С моль/л, то Ch моль/л – это концентрация той части аниона А-, которая подверглась гидролизу и образовала Ch моль/л слабой кислоты HA и Ch моль/л гидроксильных ионов:
A- |
+ |
HOH |
<—> |
HA |
+ |
OH- |
C-Ch |
|
|
Ch |
|
Ch |
|
где: h – степень гидролиза, т.е доля
молекул соли, подвергающихся
гидролизу.
Константа гидролиза
соли:
![]()
При малом значении h: Kг=Сh2
откуда
![]() .
Так
как [HA]=[OH-]=C , то Kг=[OH- ]2
/C; [H+]=Kв/[OH- ]=Kв/Kк
, pH=-lg[H+].
.
Так
как [HA]=[OH-]=C , то Kг=[OH- ]2
/C; [H+]=Kв/[OH- ]=Kв/Kк
, pH=-lg[H+].
Аналогично соотношение можно получить и при рассмотрении гидролиза соли слабого основания и сильной кислоты: Kг=[OH- ]2 /C; [H+]=Kв/[OH- ]=Kв/Kосн
Пример: Определить pH 0.02Н раствора соды Na2C03, учитывая только первую ступень гидролиза.
Решение: Гидролиз соли протекает по уравнению
Na2CO3+HOH=NaOH+NaHCO3 или CO32-+HOH=OH-+HCO3 -
Kг=Kв/Kк=10-14/4,7•10-11=2,1•10-4
Для вычисления степени гидролиза необходимо вычислить молярную концентрацию раствора С (Na2CO3)=0,01 моль/л

ГРУППОВЫЕ НАЗВАНИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
группы элементов |
элементы |
актиноиды |
Ac, Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr |
благородные газы |
He, Ne, Ar, Kr, Xe, Rn |
галогены |
F, Cl, Br, I, At |
лантаноиды |
La, Ce, Pr, Nd, Pm, Sm, Eu, Cd, Tb, Dy, Ho, Er, Tm, Yb, Lu |
халькогены |
O, S, Se, Te, Po |
семейство железа |
Fe, Co, Ni, |
семейство платины |
Ru, Rh, Pd, Os, Ir, Pt |
щелочные металлы |
Li, Na, K, Rb, Cs, Fr |
щелочно-земельные металлы |
Ca, Sr, Ba, Ra |
ПОДГРУППА Ia. [ЩЕЛОЧНЫЕ МЕТАЛЛЫ (Li, Na, K, Rb, Cs, Fr )]
НАХОЖДЕНИЕ В ПРИРОДЕ |
Na-2,64% (по массе), K-2,5% (по массе), Li, Rb, Cs-значительно меньше, Fr- искусственно полученный элемент NaCl - поваренная соль (каменная соль), галит Na2SO4· 10H2O - глауберова соль NaNO3 - чилийская селитра Na3AlF6 - криолит Na2B4O7· 10H2O - бура KCl - сильвин KCl NaCl - сильвинит |
ФИЗИЧЕСКИЕ СВОЙСТВА |
Очень мягкие металлы, легко режутся ножом. На срезе - белого цвета с серебристым металлическим блеском, исчезающим на воздухе из-за окисления. Плотности веществ Li (0,534) , Na (0,97), K (0,86), Rb (1,532), Cs (1,87) г/см3. Тпл. Li (179) , Na (97,8), K (63,5), Rb (39,0), Cs (28,5) 0С |
ПОЛУЧЕНИЕ |
Т.к. щелочные металлы - это самые сильные
восстановители, их можно восстановить
из соединений только при электролизе
расплавов солей:
2NaCl=2Na+Cl2
на
катоде:Na++e=Na
на аноде:2Cl--e=Cl2
|
ХИМИЧЕСКИЕ СВОЙСТВА |
|
1.С кислородом (Rb, Cs - самовоспламеняются) |
2Na+O2=Na2O2; 2K+2O2=K2O4 (пероксиды) 4Li+O2=2Li2O (оксид лития) |
2.С галогенами |
2Na+Cl2=2NaCl |
3.С серой при нагревании |
2Li+S=Li2S (сульфид) |
4.Литий взаимодействует с азотом |
6Li+N2=2Li3N ( нитрид) |
5.С водородом при нагревании |
2Na+H2=2NaH (гидрид) |
6.С водой |
2Na+2H2O=2NaOH+H2 |
СОЕДИНЕНИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ Щелочные металлы - самые сильные восстановители, их ионы не проявляют окислительных свойств |
||
Гидроксиды(едкие щелочи) - твердые кристаллические вещества, типично ионные соединения, сильные основания. NaOH-едкий натр, каустическая сода KOH-едкое кали Получение: 1.Электролиз водного раствораNaCl: катод: H2O+2e=H2 +2OH- анод: 2Cl--2e=Cl2 суммарная реакция: 2H2O+2NaCl=2NaOH+Cl2 +H2 |
Соли - типично ионные соединения, как
правило-хорошо растворимы в воде,
кроме некоторых солей лития. Образованные
слабыми кислотами сильно
гидролизуются.
Na2CO3
10H2O - кристаллическая сода
Na2CO3
- кальцинированная сода
NaHCO3
- питьевая сода
K2CO3 -
поташ
Получение соды:
1.Аммиачный
способ - насыщение раствора NaCl газами
CO2 и NH3
NH3+CO2+H2O=NH4HCO3
NH4HCO3 +NaCl=NaHCO3 |
Качественные реакции: окрашивание пламени ионами Li+ - карминово-красное Na+ - желтое K+ - фиолетовое |
Свойства элементов подгруппы меди
Атомный номер |
Название |
Электронная конфигурация |
ρ г/см3 |
t0пл. 0C |
t0кип. 0C |
ЭО |
Атомный радиус, нм |
Удельная злектро- проводность м,мм-2,ом-1 |
Степень окисления |
29 |
Медь Cu |
[Ar] 3d104s1 |
8,96 |
1083 |
2595 |
1,9 |
0,127 |
58,1 |
+1,+2 |
47 |
Серебро Ag |
[Kr] 4d105s1 |
10,5 |
960 |
2180 |
1,9 |
0,144 |
61,0 |
+1 |
79 |
Золото Au |
[Xe]4f145d106s1 |
19,3 |
1064 |
2700 |
2,4 |
0,144 |
41,3 |
+1,+3 |
Физические свойства. Высокие значения плотности, температур плавления и кипения. Высокая тепло- и электропроводность.
Химические свойства. Химическая активность небольшая, убывает с увеличением атомного номера.
Медь и её соединения.
Получение
Пирометаллургия:
CuO + C
![]() Cu
+ CO
Cu
+ CO
CuO + CO Cu + CO2
Гидрометаллургия:
CuO + H2SO4 CuSO4 + H2O CuSO4 + Fe FeSO4 + Cu
Электролиз:
2CuSO4 + 2H2O 2Cu + O2 + 2H2SO4 (на катоде) (на аноде)
Химические свойства
Взаимодействует с неметаллами при высоких температурах:
2Cu + O2 2CuO Cu + Cl2 CuCl2
Медь стоит в ряду напряжений правее водорода, поэтому не реагирует с разбавленными соляной и серной кислотами, но растворяется в кислотах – окислителях:
3Cu + 8HNO3(разб.) 3Cu(NO3)2 + 2NO + 2H2O Cu + 4HNO3(конц.) Cu(NO3)2 + 2NO2 + 2H2O Cu + 2H2SO4(конц.) CuSO4 + SO2 +2H2O
Сплавы меди с оловом - бронзы, с цинком - латуни.
Соединения одновалентной меди
Встречаются либо в нерастворимых соединениях (Cu2O, Cu2S, CuCl), либо в виде растворимых комплексов (координационное число меди – 2):
CuCl + 2NH3 [Cu(NH3)2]Cl
Оксид меди (I) - красного цвета, получают восстановлением соединений меди (II), например, глюкозой в щелочной среде:
2CuSO4 + C6H12O6 + 5NaOH Cu2O + 2Na2SO4 + C6H11O7Na + 3H2O
Соединения двухвалентной меди
Оксид меди (II) - чёрного цвета. Восстанавливается под действием сильных восстановителей (например, CO) до меди. Обладает основным характером, при нагревании растворяется в кислотах:
CuO + H2SO4 CuSO4 + H2O CuO + 2HNO3 Cu(NO3)2 + H2O
Гидроксид меди (II) Cu(OH)2 - нерастворимое в воде вещество светло-голубого цвета. Образуется при действии щелочей на соли меди (II):
CuSO4 + 2NaOH Cu(OH)2 + Na2SO4
При нагревании чернеет, разлагаясь до оксида:
Cu(OH)2 CuO + H2O
Типичное основание. Растворяется в кислотах.
Cu(OH)2 + 2HCl CuCl2 + 2H2O Cu(OH)2 + 2H+ Cu2+ + 2H2O
Растворяется в растворе аммиака с образованием комплексного соединения (координационное число меди – 4) василькового цвета (реактив Швейцера, растворяет целлюлозу):
Cu(OH)2 + 4NH3 [Cu(NH3)4](OH)2
Малахит Cu2(OH)2CO3. Искусственно можно получить по реакции:
2CuSO4 + 2Na2CO3 + H2O Cu2(OH)2CO3 + 2Na2SO4 + CO2
Разложение малахита: Cu2(OH)2CO3 2CuO + CO2 + H2O
Дополнительную информацию о меди , её свойствах и применении можно получить здесь
Серебро и его соединения
Благородный металл, устойчивый на воздухе. При потускнении серебра происходит реакция Гепара:
4Ag + 2H2S + O2 2Ag2S + 2H2O
В ряду напряжений находится правее водорода, поэтому растворяется только в кислотах - окислителях:
3Ag + 4HNO3(разб.) 3AgNO3 + NO + 2H2O Ag + 2HNO3(конц.) AgNO3 + NO2 + H2O 2Ag + 2H2SO4(конц.) Ag2SO4 + SO2 + 2H2O
В соединениях серебро обычно проявляет степень окисления +1. Растворимый нитрат серебра AgNO3 используется как реактив для качественного определения Cl-, Br-, I-:
Ag+ + Cl- AgCl белый Ag+ + Br- AgBr светло-жёлтый Ag+ + I- AgI тёмно-жёлтый
(Способность этих осадков образовывать растворимые комплексные соединения уменьшаются в ряду AgCl – AgBr – AgI). На свету галогениды серебра постепенно разлагаются с выделением серебра. При добавлении растворов щелочей к раствору AgNO3 образуется тёмно-коричневый осадок оксида серебра Ag2O:
2AgNO3 + 2NaOH Ag2O + 2NaNO3 + H2O
Осадки AgCl и Ag2O растворяются в растворах аммиака с образованием комплексных соединений (координационное число серебра – 2):
AgCl + 2NH3 [Ag(NH3)2]Cl Ag2O + 4NH3 + H2O 2[Ag(NH3)2]OH
Аммиачные комплексы серебра взаимодействуют с альдегидами (реакция серебряного зеркала):
|
O II |
|
O II |
|
R – |
C |
+ [Ag(NH3)2]OH R– |
C |
+ Ag + NH3 |
|
I H |
|
I O |
-NH4 |
Золото и его соединения
Золото - мягче Cu и Ag, ковкий металл; легко образует тончайшую фольгу; благородный металл, устойчив как в сухом, так и во влажном воздухе. Растворим только в смеси концентрированных соляной и азотной кислот ("царской водке"):
Au + HNO3 + 4HCl H[AuCl4] + NO + 2H2O
Реагирует с галогенами при нагревании:
2Au + 3Cl2 2AuCl3
Соединения термически не очень устойчивы и разлагаются при нагревании с выделением металла. Комплексообразователь (комплексы золота (III) обладают координационными числами 4, 5 и 6).
Атомный номер |
Название |
Электронная конфигурация |
Атомный радиус, нм |
ρ г/см3 |
t0пл. 0С |
t0кип. 0С |
ЭО |
Степени окисления |
30 |
Цинк Zn |
[Ar]3d104s2 |
0,132 |
7,13 |
419,4 |
907 |
1,6 |
+2 |
48 |
Кадмий Cd |
[Kr]4d105s2 |
0,148 |
8,64 |
320,9 |
767 |
1,7 |
+2 |
80 |
Ртуть Hg |
[Xe]4f145d106s2 |
0,15 |
13,59 |
-38,8 |
357 |
1,9 |
+1,+2 |
