
- •1. Квантовые числа.
- •2.Принцип Паули, правило Гунда, правило Клечковского, принцип наименьшей энергии.
- •5. Химическая связь. Виды химических связей.
- •6. Метод валентных связей. Свойства ковалентной связи. Насыщаемость, направленность, поляризуемость.
- •Метод валентных связей.
- •7. Метод молекулярных орбиталей. Связывающие и разрыхляющие орбитали. Порядок связи.
- •8.Основные термодинамические понятия: система, параметры и функции состояния. Внутренняя энергия. Энтальпия.
- •10. Закон Гесса. Тепловые эффекты химических реакций. Примеры расчетов.
- •11. Энтропия как функция состояния. Изменение энтропии в химических реакциях.
- •Изменение энтропии.
- •14. Свободная энергия Гиббса. Условия самопроизвольного протекания процессов в изобарно-изотермических условиях.
- •15.Энергия Гельмгольца. Условия самопроизвольного протекания процессов в изохорно-изотермических условиях.
- •16.Скорость химической реакции. Факторы, влияющие на скорость реакции.
- •17. Константа скорости химической реакции. Простые и сложные реакции. Порядок и молекулярность реакций.
- •Одностадийные реакции.
- •Сложные химические реакции.
- •19. Теория активных молекул. Энергия активации. Теория активированного комплекса.
- •21.Каталитические реакции. Гомогенный и гетерогенный катализ.
- •22. Условия химического равновесия. Константа химического равновесия для гомогенных и гетерогенных систем.
- •23. Химическое равновесие(см пред).Принцип Ле-Шателье.
- •24.Криоскопия и эбулиоскопия.
- •25. Растворы. Химическое равновесие в растворах электролитов.
- •28. Дисперсные системы. Основные виды дисперсных систем.
- •29. Коллоиды. Строение мицеллы.
- •30. Коагуляция и пептизация. Роль электролитов и пав.
- •31. Окислительно-восстановительные реакции. Направление их протекания . Red-ox потенциалы.
- •32. Скачок потенциала на границе «металл-раствор». Равновесные потенциалы. Стандартные потенциалы. Ряд стандартных электронных потенциалов.
- •33. Теория гальванического элемента. Эдс. Связь эдс с энергией Гиббса.
- •34 .Стандартный водородный электрод. Зависимость потенциала водородного электрода от рН раствора.
- •35. Электроды первого рода. Стандартные электродные потенциалы металлов. Уравнеиние Нернста.
- •Уравнение Нернста.
- •38. Поляризация в гальваническом элементе. Типы поляризации. Причины возникновения и способы ее устранения.
- •39. Электрохимическая коррозия. Коррозия с водородной и кислородной деполяризацией.
- •Коррозия с водородной и кислородной деполяризацией.
- •42. Электролиз. Анодное окисление и катодное восстановление. Последовательность разряда ионов.
- •43. Концентрационная и химическая поляризация. Явление перенапржения. Потенциал разложения электролита.
- •44. Электролиз с растворимым и нерастворимым анодом.
- •45. Методы очистки металлов. Электрохимическое рафинирование.
- •46. Правило фаз Гиббса. Диаграммы состояния одно- и двухкомпонентных систем.
- •47. Элементы термического анализа.
5. Химическая связь. Виды химических связей.
Химичекая связь. Одной из фундаментальных основ химической связи явилась теория химического строения A.M. Бутлерова (1861 г.), согласно которой свойства соединений зависят от природы и числа составляющих их частиц и химического строения. Эта теория нашла подтверждение не только для органических, но и неорганических веществ, поэтому ее следует считать фундаментальной теорией химии.
Под химической связью понимаются различные виды взаимодействий, обусловливающие устойчивое существование двух- и многоатомных соединений: молекул, ионов, кристаллических и иных веществ.
Основными чертами химической связи являются:
а) снижение общей энергии двух- или многоатомной системы по сравнению с суммарной энергией изолированных частиц, из которых эта система образована;
б) перераспределение электронной плотности в области химической связи по сравнению с простым наложением электронных плотностей несвязанных атомов, сближенных на расстояние связи.
По своей природе химическая связь представляет собой взаимодействие между положительно заряженными ядрами и отрицательно заряженными электронами, а также электронов друг с другом.
Основные виды связей. К основным видам химической связи относятся ионная, ковалентная и металлическая связи. Кроме того, между молекулами возникает водородная химическая связь и происходят вандерваальсовы взаимодействия.
Ионная связь представляет собой электростатическое взаимодействие положительно и отрицательно заряженных ионов в химическом соединении.
Химическая связь, образованная путем обобществления пары электронов двумя атомами, называется ковалентной связью
Металлическая – связь между атомами металлов.
В 1916 г. немецким ученым В. Косселем была высказана идея о том, что атомы при взаимодействии либо отдают, либо приобретают электроны, превращаясь при этом соответственно в катионы или анионы, имеющие устойчивые электронные конфигурации. Взаимное их притяжение обусловливает химическую связь. Идеи Косселя легли в основу разработки теории ионной химической связи.
В том же году американский ученый Г. Льюис предположил, что устойчивые внешние электронные конфигурации у молекул могут возникнуть в результате обобществления электронов. Связь, образованная за счет обобществленной пары электронов, поставляемых по одному от каждого атома, получила тогда название ковалентной связи.
Химическая связь в большинстве химических соединений сочетает свойства ковалентной и ионной связи. Поэтому ее можно считать ковалентной с определенной долей ионности. Степень ионности характеризуется эффективным зарядом атомов и возрастает с увеличением разности электроотрицательностей.
6. Метод валентных связей. Свойства ковалентной связи. Насыщаемость, направленность, поляризуемость.
Общие понятия. Химическая связь, образованная путем обобществления пары электронов двумя атомами, называется ковалентной связью.
Рассмотрим для примера образование ковалентной связи в молекуле водорода. При сближении атомов водорода происходит проникновение их электронных облаков друг в друга, которое называется перекрыванием электронных облаков. Электронная плотность между ядрами возрастает. Ядра притягиваются друг к другу. Вследствие этого снижается энергия системы. При очень сильном сближении атомов возрастает отталкивание ядер. Поэтому имеется оптимальное расстояние между ядрами (длина связи lсв), при котором система имеет минимальную энергию. При таком состоянии выделяется энергия, называемая энергией связи Есв.
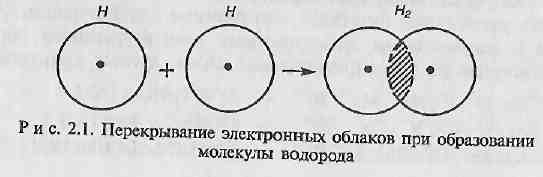
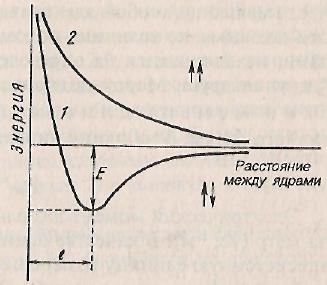
Рис. 2.2. Зависимость энергии систем из двух атомов водорода с антипараллельными (1) и параллельными (2) спинами от расстояния между ядрами (E-энергия связи)
Особенностями ковалентной химической связи являются ее направленность и насыщаемость. Так как атомные орбитали пространственно ориентированы, то перекрывание электронных облаков происходит по определенным направлениям, что и обусловливает направленность ковалентной связи. Количественно направленность выражается в виде валентных углов между направлениями химической связи в молекулах и твердых телах.
Насыщаемость ковалентной связи вызывается ограничением числа электронов, находящихся на внешних оболочках, которые могут участвовать в образовании ковалентной связи.
Полярность ковалентной связи. Если ковалентная связь образована одинаковыми атомами, например Н − Н, О = О, С1 − CI, N ≡ N, то обобществленные электроны равномерно распределены между ними.
Такая связь называется ковалентной неполярной связью. Если же один из атомов сильнее притягивает электроны, то электронная пара смещается в сторону этого атома. В этом случае возникает полярная ковалентная связь. Критерием способности атома притягивать электрон может служить электроотрицательность. Чем выше ЭО у атома, тем более вероятно смещение электронной пары в сторону ядра данного атома. Поэтому разность электроотрицательности атомов характеризует полярность связи.
