
- •Закон эквивалентов.
- •Предмет и содержание химической кинетики. Основные определения и понятия.
- •Гомогенные и гетерогенные процессы. Скорость их протекания.
- •Зависимость скорости процессов от концентрации реагирующих веществ. Закон действия масс (здм).
- •Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса. Энергия активации.
- •Зависимость скорости реакции от площади поверхности взаимодействия (гетерогенный процесс).
- •Зависимость скорости реакции от катализатора. Механизм его действия.
- •Обратимые и необратимые процессы. Химическое равновесие. Кинетическое условие химического равновесия.
- •Константа равновесия. Зависимость от различных факторов.
- •Смещение химического равновесия. Принцип Ле Шателье.
- •Общая характеристика растворов.
- •Способы выражения концентрированных растворов.
- •Растворы электролитов. Электролитическая диссоциация и механизм её протекания. Диссоциация кислот, солей и оснований.
- •Слабые электролиты. Константа диссоциации, степень диссоциации. Закон разбавления Оствальда. Определение концентрации ионов в слабых электролитов.
- •Произведение растворимости для труднорастворимых солей.
- •Ионное произведение воды. Водородный (рН) и гидроксильный (рОн) показатели.
- •Сильные электролиты. Активность ионов. Ионная сила электролитов. Определение концентрации ионов в сильных электролитах.
- •Гидролиз солей. Константа гидролиза и степень гидролиза.
- •Овр. Метод электронно-ионных схем для написания овр.
- •Комплексные соединения.
- •Современная теория строения атома.
- •Квантовые числа (n,l,m,s).
- •Многоэлектронные атомы. Принцип Паули. Правило Хунда. Правило Клечковского.
- •Периодический закон и таблица Менделеева. Электронная структура атомов.
- •Периодичность свойств элементов по таблице Менделеева. Энергия ионизации. Энергия сродства к электрону. Электроотрицательность. Степень окисления и ионные радиусы.
- •Значение периодического закона.
- •Основные характеристики химической связи: длина связи, прочность связи, направленность связи (валентные углы).
- •Квантово-механическое объяснение химической связи (на примере молекулы н2).
Произведение растворимости для труднорастворимых солей.

Если ПК = ПР,– система находится в состоянии равновесия (раствор насыщенный).
Если ПК < ПР,– самопроизвольно протекает процесс растворения осадка.
Если ПК > ПР,– возможен только обратный процесс – выпадение осадка.
Ионное произведение воды. Водородный (рН) и гидроксильный (рОн) показатели.
Вода является слабым электролитом и диссоциирует обратимо по уравнению
![]()
Численное
значение
 воды определено экспериментально по
данным электропроводности при 298 К и
равно 1,86⋅10 –16.
воды определено экспериментально по
данным электропроводности при 298 К и
равно 1,86⋅10 –16.
![]()
Ионное произведение воды.
![]()
![]()
В нейтральных средах рН = рОН = 7, в кислых средах рН<7, в щелочных – рН>7.
![]()
Сильные электролиты. Активность ионов. Ионная сила электролитов. Определение концентрации ионов в сильных электролитах.
Если α>0,3 такие электролиты называются сильными.
Активность ионов — эффективная концентрация с учетом электростатического взаимодействия между ионами в растворе.
 ,
где
,
где
 - активность ионов,
- активность ионов,
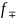 - сила межионного взаимодействия.
- сила межионного взаимодействия.
 ,
где
,
где
 -
ионная сила электролита, z
– заряд ионов.
-
ионная сила электролита, z
– заряд ионов.
Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда.
 ,
где
,
где
 - молярная концентрация ионов.
- молярная концентрация ионов.
Гидролиз солей. Константа гидролиза и степень гидролиза.
Гидролиз солей - это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита.



 – степень
гидролиза.
– степень
гидролиза.
h зависит от природы соли, концентрации и температуры.


Овр. Метод электронно-ионных схем для написания овр.
Химические реакции, сопровождающиеся изменением степеней окисления атомов одного или нескольких элементов, входящих в состав реагирующих веществ, называются окислительно–восстановительными (ОВР).
1.
Если образующиеся соединения содержат
больше кислорода чем исходное, то
недостающее количество кислорода
пополняется в кислой
и нейтральной
средах за счёт воды с образованием в
продуктах реакции ионов
 .
А в щелочной
среде – пополняется за счёт групп
.
А в щелочной
среде – пополняется за счёт групп
 с образованием продуктов реакции
молекул воды.
с образованием продуктов реакции
молекул воды.
2. Если образующее соединение содержится меньше кислорода чем исходное, то освобождающийся кислород в кислой среде взаимодействует с ионами с образованием в продуктах реакции молекул воды. А в щелочной и нейтральной средах взаимодействуют с молекулами воды с образованием в продуктах реакции гидроксильных групп .
Комплексные соединения.
Молекулярные соединения, образующие комплексные ионы, способные к существованию как в растворе, так и в кристалле, называются комплексными соединениями. Центральный атом внутренней сферы, вокруг которого группируются ионы или малекулы, называется комплексообразователем.
Частицы, которые группируются вокруг комплексообразователя называются лигандами. Число, которое показыает сколько лигандов находится вокруг комлексообразователя, называется координационным числом (2,4,6).
Комплексный ион может быть как катионом так и анионом. Заряд комплексного иона равен по величине и противоположен по знаку внешней сфере. Заряд комплексного иона равен алгебраической сумме зарядов, которые составляют данный ион.
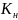 показывает
способность комплексного иона распадаться
на ионы.
показывает
способность комплексного иона распадаться
на ионы.
