
- •Закон эквивалентов.
- •Предмет и содержание химической кинетики. Основные определения и понятия.
- •Гомогенные и гетерогенные процессы. Скорость их протекания.
- •Зависимость скорости процессов от концентрации реагирующих веществ. Закон действия масс (здм).
- •Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса. Энергия активации.
- •Зависимость скорости реакции от площади поверхности взаимодействия (гетерогенный процесс).
- •Зависимость скорости реакции от катализатора. Механизм его действия.
- •Обратимые и необратимые процессы. Химическое равновесие. Кинетическое условие химического равновесия.
- •Константа равновесия. Зависимость от различных факторов.
- •Смещение химического равновесия. Принцип Ле Шателье.
- •Общая характеристика растворов.
- •Способы выражения концентрированных растворов.
- •Растворы электролитов. Электролитическая диссоциация и механизм её протекания. Диссоциация кислот, солей и оснований.
- •Слабые электролиты. Константа диссоциации, степень диссоциации. Закон разбавления Оствальда. Определение концентрации ионов в слабых электролитов.
- •Произведение растворимости для труднорастворимых солей.
- •Ионное произведение воды. Водородный (рН) и гидроксильный (рОн) показатели.
- •Сильные электролиты. Активность ионов. Ионная сила электролитов. Определение концентрации ионов в сильных электролитах.
- •Гидролиз солей. Константа гидролиза и степень гидролиза.
- •Овр. Метод электронно-ионных схем для написания овр.
- •Комплексные соединения.
- •Современная теория строения атома.
- •Квантовые числа (n,l,m,s).
- •Многоэлектронные атомы. Принцип Паули. Правило Хунда. Правило Клечковского.
- •Периодический закон и таблица Менделеева. Электронная структура атомов.
- •Периодичность свойств элементов по таблице Менделеева. Энергия ионизации. Энергия сродства к электрону. Электроотрицательность. Степень окисления и ионные радиусы.
- •Значение периодического закона.
- •Основные характеристики химической связи: длина связи, прочность связи, направленность связи (валентные углы).
- •Квантово-механическое объяснение химической связи (на примере молекулы н2).
Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса. Энергия активации.
Правило Вант-Гоффа: при увеличении температуры на каждые 10° скорость большинства химических реакций возрастает примерно в 2 – 4 раза
![]()
![]()
 –
энергия
активации реакции, т.е. минимальная
энергия, которую необходимо сообщить
частицам, чтобы их взаимодействие
было эффективным, выражается в
–
энергия
активации реакции, т.е. минимальная
энергия, которую необходимо сообщить
частицам, чтобы их взаимодействие
было эффективным, выражается в
 .
.
Численное значение зависит от природы реагирующих веществ и присутствия катализатора. Если Т 2 – Т 1 = 10, то выражение примет вид:
![]()
 ,
A
– предэкспоненциальный множитель,
,
A
– предэкспоненциальный множитель,
 ,
где z
– число соударений, p
– стерический множитель, который
выражает ориентацию частиц в пространстве.
,
где z
– число соударений, p
– стерический множитель, который
выражает ориентацию частиц в пространстве.
Зависимость скорости реакции от площади поверхности взаимодействия (гетерогенный процесс).
Гетерогенная система – вещества находятся в различных фазах и между ними есть поверхности раздела.

Зависимость скорости реакции от катализатора. Механизм его действия.
Скорость реакции зависит от катализатора.
Катализом называется изменение скорости химической реакции под действием каких либо веществ, которые принимая участие в химической реакции к концу её остаются неизменными.
Механизм действия катализатора заключается в том, что в присутствии его, реакция протекает через ряд промежуточных стадий, каждая из которых характеризуется меньшим значением .
Обратимые и необратимые процессы. Химическое равновесие. Кинетическое условие химического равновесия.
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях. Химическое равновесие – состояние обратимого процесса, при котором скорость прямой реакции равна скорости обратной реакции.
 -
кинетическое условие равновесия.
-
кинетическое условие равновесия.
Константа равновесия. Зависимость от различных факторов.
Любое химическое равновесие характеризуется константой равновесия.

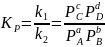
 зависит
от природы веществ и от температуры,
но не зависит от концентрации, давления
и катализатора.
зависит
от природы веществ и от температуры,
но не зависит от концентрации, давления
и катализатора.
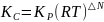 ,
△N
= c+d-a-b
,
△N
= c+d-a-b
 ри
повышении температуры (если △H>0),
и уменьшается при понижении температуры
(если △H<0).
ри
повышении температуры (если △H>0),
и уменьшается при понижении температуры
(если △H<0).
показывает глубину протекания процесса, т.е. показывает какие вещества(продукты или исходные) преобладают в системе к моменту наступления равновесия. Если >1, то в системе преобладают продукты реакции, а если <1, то преобладают исходные вещества.
Смещение химического равновесия. Принцип Ле Шателье.
Принцип Ле Шателье: если на систему находящуюся в состоянии химического равновесия оказать какое либо внешнее воздействие, то равновесие смещается в ту сторону, которая ослабляет это воздействие.
При уменьшении равновесной концентрации исходных веществ равновесие смещается в сторону обратной реакции, приводящей к увеличению концентрации исходных веществ, и наоборот. Увеличение концентрации исходных веществ смещает равновесие в сторону прямой реакции.
Увеличение давления в равновесной системе смещает равновесие в сторону образования меньшего числа молей газообразных веществ, т.е. в сторону реакции, уменьшающей реакции.
Повышение температуры смещает равновесие в сторону эндотермической реакции, идущей с поглощением энергии (∆Н > 0), понижение температуры – в сторону экзотермической реакции, идущей с выделением энергии (∆Н < 0). Численное значение константы равновесия при повышении температуры увеличивается в эндотермических процессах и уменьшается в экзотермических процессах.
