
- •Для уменьшения Uкл следует:
- •Электролиз в условиях конкуренции
- •▲ Электролиз раствора Na2so4 (электроды Pt)
- •Правила катодного восстановления
- •Правила анодного окисления анодного
- •Гальваника – нанесение Ме покрытий на изделие (гальванические покрытия)
- •Гальваническая ванна
- •Электролиз в металлургии – рафинированиe
- •Инертный
- •Электрод
- •Металл c
- •Примесями
- •РастворН2so4
![]()








Электролиз подчиняется законом Фарадея и кинетическим законам. Для принудительного процесса (не протекающего самопроизвольно в прямом направлении):
Аmin
приложенная к системе=
G
G
= nFUmin
Umin
= ЕЭ
=
EA
- EK
i =0
i=0

Под действием тока потенциалы электродов электролизера изменяютcя – поляризация: ЕК – более отрицательным
ЕА – более положительным
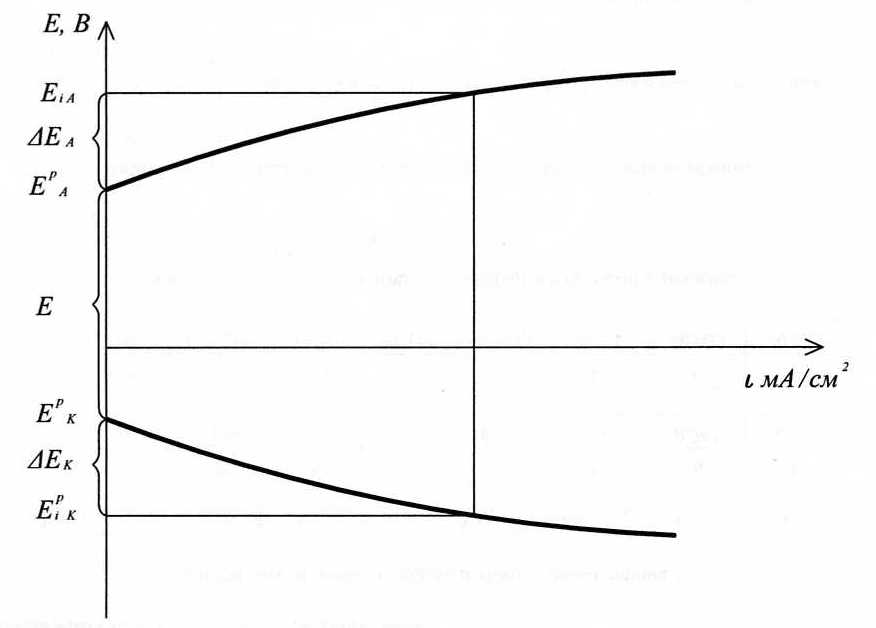
Поляризационные
кривые при электролизе
Клемовое напряжение (напряжение электролизера) вследствие поляризации и омических потерь увеличивается
Uкл=Umin
+ (∆EA
- ∆EK)
+ I(R1+R2)
Увеличение Uкл приводит к перерасходу энергии по сравнению с рассчитанной по уравнениям химической термодинамики
Для уменьшения Uкл следует:
для
↓
омических потерь: -
использовать электролит с высокой
электропроводностью
-
уменьшить
расстояние между электродами -
↑ Т; ↑
Sэлектродов
; ↓ Среагента
;
для
↓
концентрационной
и э/х поляризации: -
↑
Sэлектродов;
↑ Т;
↑ Среагента
;
-
перемешивать; -
использовать электроды-катализаторы; -
↓
ток
Ионный состав расплава: KOH → K+ + OH-
Электроды: графит Ств - инертный
К: K+ + e → K0 (Bi=100%)
![]() А:
4OH-
→
O2↑
+ 2H2O
+ 4e
(Bi=100%)
А:
4OH-
→
O2↑
+ 2H2O
+ 4e
(Bi=100%)
По закону Фарадея
![]()

Ионный состав : Н2Ож Н+р + ОН-р рН = 7
Электроды: Pt - инертные
К: 2Н+р + 2е → Н2 ↑ (Bi=100%)
А: 4OH- → O2↑ + 2H2O + 4e (Bi=100%)
2Н2Ож 2Н2 ↑ + О2 ↑
ЕН+/Н2 = -0,059рН = -0,414 В
ЕО2/ОН- =1,23 – 0,059рН = 1,23 – 0,414 = 0,816 В
Umin = ЕО2/ОН- - ЕН+/Н2 =1,23 В
 Е, В
Е, В


 0,816
0,816
Umin
i
 -0,414
-0,414

Электролиз в условиях конкуренции
Ионный
состав раствора: Na2SO4
ж
↔ 2Na+p
+ SO42-p
Н2Ож
↔
Н+р
+ ОН-р
рН = 7
(нет
гидролиза) [-
K]:
Na+,
Н+
[+A]:
SO42-,
ОН-▲ Электролиз раствора Na2so4 (электроды Pt)
Правила катодного восстановления
◄ в первую очередь восстанавливаются наиболее сильные
окислители, потенциал которых наибольший
Е0Na+/ Na = - 2,9В ЕрН+/Н2 = -0,059рН = -0,41В
ЕрН+/Н2 > Е0Na+/ Na на 2,49В
восстанавливаться будет ион водорода Н+
◄ если разница потенциалов частиц в приэлектродном слое
меньше 1В, возможны оба процесса.





Правила анодного окисления анодного
◄ в первую очередь окисляются наиболее сильные
восстановители, потенциал которых наименьший
◄ если разница потенциалов частиц в приэлектродном слое
меньше 1В, возможны оба процесса.
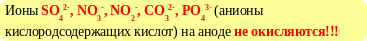





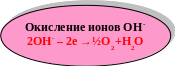

![]()
qi – кол-во электричества, пошедшее на превращение i вещества
q – общее кол-во электричества, прошедшее через электрод









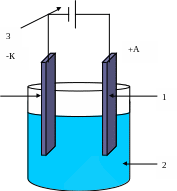
Гальваника – нанесение Ме покрытий на изделие (гальванические покрытия)
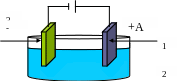

- K
+A
