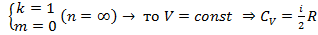- •Материальная точка. Абсолютно твердое тело. Тело отсчета. Система отсчета. Кинематический закон движения материальной точки. Траектория. Вектор перемещения. Путь.
- •Динамика материальной точки. Масса. Сила. Инерциалные системы отсчета. Законы Ньютона.
- •Законы Ньютона
- •Преобразования Галилея, принцип относительно Галилея
- •Потенциальная энергия гравитационного взаимодействия и упругой деформации.
- •Абсолютно не упругий и абсолютно упругий центральные удары шаров.
- •Основное уравнение вращательного движения.
- •Параметры состояния термодинамической системы
- •Внутренняя энергия идеального газа. Понятие числа степеней свободы молекулы. Теорема о равнораспределении энергии по степеням свободы. Расчет внутренней энергии идеатыюго газа.
- •Теплота. Работа в термодинамике. Первое начало термодинамики. Расчет величин, входящих в первое начало термодинамики. Применение первого начала термодинамики к изопроцессам в идеальном газе.
- •Связь между теплоемкостью идеального газа в политропном процессе и показателем политропы.
- •Статистический смысл второго начала
- •Число столкновения молекул за единицу времени:
- •Барометрическая формула. Распределение Вольцмана.
- •Функция распределения и ее смысл
- •Полная энергия
Внутренняя энергия идеального газа. Понятие числа степеней свободы молекулы. Теорема о равнораспределении энергии по степеням свободы. Расчет внутренней энергии идеатыюго газа.
Всекая
система обладаеют энергией, которой
складывается из энергии системы и
механической энергии системы и внутренной
энергии, которые связаны с внутрением
свойства стенки.![]()
И
так ![]()
![]()
![]()
+)Процесс изменения состояния изменяет внутреннюю энергию.
+)
Изменение внутренной энергии ![]()
Тогда
![]()
Дифференциальный процесс
![]()
Для
любой процесса ![]()
Число степеней свободы ( i ) тела называется минимальным числом независимых переменных, однозначно определяющих положение тела в пространстве (или минимальное число независимых перемещений тела в пространстве)
Теорема
Больцмана о равномерном распределении
энергии молекул по степеням свободы
звучит
следующим образом: если система молекул
находится в тепловом равновесии при
температуре Т, то средняя кинетическая
энергия молекул равномерно распределена
по степеням свободы, причем на каждую
степень свободы приходится жнергия ![]()
Теплота. Работа в термодинамике. Первое начало термодинамики. Расчет величин, входящих в первое начало термодинамики. Применение первого начала термодинамики к изопроцессам в идеальном газе.
Под теплотой и количествами теплоты, понимаем передачу энергии от того телу другому, расчет хаотическое движение максимум, и взаимодействуют друг другу, характеризующему особеность тепломы. Эта передача на молярный уровень.
Теплота подводится или отводится прцесса изменение состояния вещества. Поэтому мы говорим, что теплота функция процесса . Введем движение от энергии функция состояния.
Q – функция процесса
U – функция состояния
U – изменение внутреннего энергии
Q – элементальная теплота
dU – безконечно мало изменения внутреннего энергии
Эксперименты установленны, что теплота самопроизвольно передается от теплого к холодному (от большой температуры до меньшой температуры)
Пусть имеем цилиндр с площадью которого S. Пусть под действием с микро подвижностью поршня. Слева от поршня находится газ, который мы можем вводить.
Пусть
подействие сила давления действующое
на dx,
тогда можем говорить из работы сила на
перемещение ![]()
![]()
![]() если V
> 0 при этом газ совершил работу
если V
> 0 при этом газ совершил работу
![]() если V
< 0 при этом внешняя сила совершило
работу на газ
если V
< 0 при этом внешняя сила совершило
работу на газ
![]()
Передача изменения состояния вещества, а изменение внутренней энергии, миожно подводить 2 способ:
Либо подводит системе теплоту
Либо совершает на систему работы то есть взаимодействием силом
![]()
Первый закон термодинамики: Изменение внутренней энергии системы равно сумме работы, совершенной внешними силами над системой, и колическтва теплоты,сообщенного системе.
![]() :
работа внешнего силы
:
работа внешнего силы
2 формировка
Обогнячим
работу, совершенную системой против
внешних сил как ![]()
![]()
Первый закон термодинамики: Количество теплоты, сообщенное системе, расходуется на изменение внутренней энергии этой системы и на совершение системой работы над внешними телами.
Q > 0 – подвод тепла
Q < 0 – отвод тепла
Газ расширяется – A > 0
Газ сжимается – A < 0
Температура
повышается - ![]()
Температура
убывается - ![]()
Применение первого начала термодинамики к изопроцессам в идеальном газе.
Изотермаческий процесс
![]()
![]()
![]()
![]()
![]()
Изохорный процесс
![]()
![]()
![]()
![]()
![]()
![]()
Изобарный процесс
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Мы получили конечные значения Ср и Сv которые отражаются друг друга
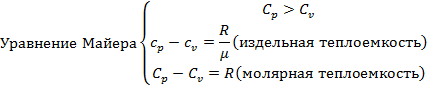
Адиабатный процесс. Вывод уравнения адиабаты. Показатель адиабаты. Применение первого начала термодинамики к адиабатному процессу.
Адиабатический процесс называется такой процессом, который проходит без подвода или отвода теплоты.Q = 0
Вывод
урвнении адиабаты, работаем ![]()
![]()
![]()
Тогда
![]()
![]()
![]()
![]()
Если
![]() = const
= const
![]()
Это уравнение Пуассона
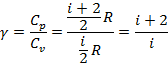
![]() показатель адиабаты
показатель адиабаты
Исползуя
отношение pV=RT
![]()
Применение первого начала термодинамики к адиабатному процессу.
Первый способ: пишем первый уравнение термодинамики за адиабатический процесс.
![]()
Где
![]()
![]()
Газ расширяется то V2 > V1
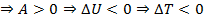
То есть температура системы убывается
Газ сжимается то V2 < V1
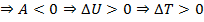
То есть температура системы повышается
Второй способ: исходим из уравнении абиабаты.
![]()
![]()
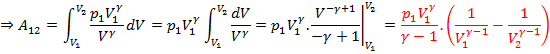
Теплоемкость в адиабатическом процессе:
![]()
Теплоемкость в адиабатическом процессе равна нулью
Политропные процессы в идсатьиом газе. Уравнение политропы. Изопроцессы и адиабатный процесс, как частные случаи политронного процесса. Связь между теплоемкостью идеального газа в политропном процессе и показателем политропы. Ограниченность классической теории теплоемкости.
Определение: процесс в теории, в коротом теплоемкость является постоянным величиной, называется политропным проессом.
(теплоемкость изменяется)
![]()
![]()
Пусть
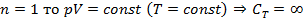
Пусть
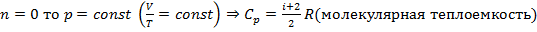
Пусть
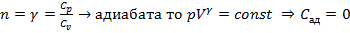
Пусть