
- •Материальная точка. Абсолютно твердое тело. Тело отсчета. Система отсчета. Кинематический закон движения материальной точки. Траектория. Вектор перемещения. Путь.
- •Динамика материальной точки. Масса. Сила. Инерциалные системы отсчета. Законы Ньютона.
- •Законы Ньютона
- •Преобразования Галилея, принцип относительно Галилея
- •Потенциальная энергия гравитационного взаимодействия и упругой деформации.
- •Абсолютно не упругий и абсолютно упругий центральные удары шаров.
- •Основное уравнение вращательного движения.
- •Параметры состояния термодинамической системы
- •Внутренняя энергия идеального газа. Понятие числа степеней свободы молекулы. Теорема о равнораспределении энергии по степеням свободы. Расчет внутренней энергии идеатыюго газа.
- •Теплота. Работа в термодинамике. Первое начало термодинамики. Расчет величин, входящих в первое начало термодинамики. Применение первого начала термодинамики к изопроцессам в идеальном газе.
- •Связь между теплоемкостью идеального газа в политропном процессе и показателем политропы.
- •Статистический смысл второго начала
- •Число столкновения молекул за единицу времени:
- •Барометрическая формула. Распределение Вольцмана.
- •Функция распределения и ее смысл
- •Полная энергия
Параметры состояния термодинамической системы
Давление
 ,
здесь dFn
– элемента силы давления, действующая
перепендикулярно площади. Площадь dS.
,
здесь dFn
– элемента силы давления, действующая
перепендикулярно площади. Площадь dS.
![]()
С точки зрения МКТ – давление есть результат взаимодействия атомов и молекулов со стороны сосуда.
Температура – в наших ощущениях Т воспринимается, как мера нагретости тела, есть привести в соприкосновении более наргетое тело с менее награтым телам, то через некоторое время их нагретости станут одинаковыми, при этом мы говорим, что температуры тел выровнялись, при этом мы говорим, что от более наргетого тела к менее нагретому прямо тепло.
С точки зрения МКТ температура мера средней кинетической энергии поступательно двух малекул.
Объем – простанство, ограниченное границами, для данноц массы газа, чем обльше объемы , тем больще среднее расстояние между молекулами.
Равновесное состояние – такое состяние изалированное системы, в которой она в конце концов самопроизвольно приходит и остается в этом состоянии бесконечно долго, при этом во всех тогках система Т и р окащываются одиноковыми.
![]()
Газ, полностью подчиняющимся этому уравнению называется идеальный газ.
Идеальным называется газ, взаимодействия между молекулами у которого можно пренебречь
Процесс называется равновесными, если от проходит через непрерывную последовательность равновесных состояний.
3 формы записи уравнения состояния идеального газа:
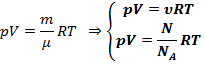
![]()
![]()
N - число молекул в единицу объема
![]()
![]()
Рассчитаем объем занимаемый газом при натураном условии Т = 273,15К, р = 1,01.105 Па
![]()
Термодинамический процесс – процесс перехода вещества изодного состояния в дргуое состояние, а возможен за счет сильного воздействия или за счет теплообмена в виде теплоты с окруность средой.
Плотность идеального газа. Связь между давлением, концентрацией и температурой. Изопроцсесы в идеальном газе.
Плотность
идеального газа ![]()
Связь
между давлением, концентрацией и
температурой ![]()
Изопроцессы – такие, в которых один из параметров поддерживается постоянными, а второй параметр является функцией третьего параметры.
Изотермический процесс T = const (m=const)

![]()
Изобаный процесс р = const (m = const)
![]()
Изохорный процесс V = const (m=const)
![]()
![]()
Основное уравнение молекулярно - кинетической теории (связь между давлением и средней кинетической энергией поступательного движения молекул газа). Связь между средней кинетической энергией поступательного движения молекулы и температурой.
Рассмотрим взаимодействия между газом со стенкой сосуды, в которой газ находится.
Основные условия:
Газ одноатомный
Газ разрежен, поэтому среднее растояние между молекулами высокие, то есть силы взаимодействия между молекулами мало, то можно рассмотрить действия друг с другом.
Размеры молекул пренебречь.
Рассмотриваем молекулы как упругие, которой обсолютно друга со стенкой сосуды.
Пусть
имеем масса одной молекулы mo.
Нормаль ![]()
![]()
![]()
![]()
Пусть
![]() :
время взаимодействия одной молекулы
со стенкой, тогда повторим закон Ньютона
:
время взаимодействия одной молекулы
со стенкой, тогда повторим закон Ньютона
![]()
![]()
![]()
Рассмотрим действия молекул на стенку площадью S, находящиеся молекулы
Числа ударов молекул от стенки равняестя
![]()
Где n: концентрация молекул в сосуде
V: объем сосуды
![]()
Где: l равняется длину, через который один молекула скоростью проходил за время
![]()
![]() так как стенки только движуются половину
молекул и с коростью vx,
так как стенки только движуются половину
молекул и с коростью vx,
![]()
Тогда суммарный импульс сил действующих на стенку за время t будет равняется.
![]()
Здезь F: суммарные силы давления, действрующие на стенку за время t
Так
как скорость ![]() разные между молекулами, то есть должны
говорить от среднего квадратного
.
разные между молекулами, то есть должны
говорить от среднего квадратного
.
![]()
![]()
Силы входяющией молекул может оденоковы.
![]()
Тогда
сила давления: ![]()
По
определению ![]()
![]()
![]() Средняя кинетическая энергия одной
молекулы
Средняя кинетическая энергия одной
молекулы
![]()
![]()
![]()
Физический смысл температуры. Средняя квадратичная скорость молекулы газа.
Температура – в наших ощущениях Т воспринимается, как мера нагретости тела, есть привести в соприкосновении более наргетое тело с менее награтым телам, то через некоторое время их нагретости станут одинаковыми, при этом мы говорим, что температуры тел выровнялись, при этом мы говорим, что от более наргетого тела к менее нагретому прямо тепло.
С точки зрения МКТ температура мера средней кинетической энергии поступательно двух малекул.
А вообщее на двух или трех атомный молекулы, скажет что температура есть мера средней кинетичекой энергии поступательного движения одной молекулы.
![]()
![]()
Средная
кинетическая квадратичная скорость
называется: ![]()


