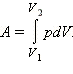- •1. Кинематика поступательного движения математической точки
- •2. Кинематика вращательного движения математической точки.
- •3. Принцип инерции Галилея. Законы Ньютона.
- •4. Преобразования Галилея. Принцип относительности Галилея.
- •5. Теорема о кинетической энергии тела. Закон сохранения механической энергии.
- •6. Импульс тела. Закон сохранения импульса.
- •7. Момент импульса. Закон сохранения момента импульса.
- •8. Момент силы. Основной закон механики вращательного движения.
- •9. Определение периода колебаний математического маятника. Гармонические колебания.
- •10. Определение периода колебаний физического маятника.
- •11. Основное уравнение мкт. Уравнение Менделеева-Клайперона.
- •12. I начало термодинамики. Изопроцессы.
- •14. Уравнение адиабаты. Адиабатический процесс. Коэффициент Пуассона.
- •15. Работа газа в изопроцессах.
- •16. Статический вес. Энтропия. III начало термодинамики.
- •17. Процессы переноса. Диффузия. Теплопроводность. Внутреннее трение.
- •18. Напряженность и потенциал электростатического поля. Принцип суперпозиции.
- •19. Электрический диполь. Механический вращающийся момент.
- •20. Теорема Гаусса. Циркуляция и ротор электростатического поля.
- •21. Циркуляция вектора. Ротор. Теорема Стокса.
14. Уравнение адиабаты. Адиабатический процесс. Коэффициент Пуассона.
Уравнение адиабаты для идеального газа: P · Vγ = const, где P — давление газа, V — его объём, γ = cP / cV — соотношение его изобарической и изохорической теплоёмкостей (всегда больше 1). Отсюда следует изменение температуры при адиабатических процессах: T1 / T2 = (P1 / P2) · (V1 / V2)γ, причём γ зависит от температуры, и в случае сильного изменения объёма и давления (раз в 10 и более) это может быть существенным. Применимо для относительно медленных процессов, когда температуры газа и ограничивающего газ слоя стенок успевают уравниваться, но теплообмен с внешней средой очень мал.
Адиабатический процесс - процесс, происходящий в изолированной системе, когда нет теплообмена с окружающей средой.
Коэффициент Пуассона (обозначается как ν или μ) характеризует упругие свойства материала. При приложении к телу растягивающего усилия оно начинает удлиняться (то есть продольная длина увеличивается), а поперечное сечение уменьшается. Коэффициент Пуассона показывает, во сколько раз изменяется поперечное сечение деформируемого тела при его растяжении или сжатии. Для абсолютно хрупкого материала коэффициент Пуассона равен 0, для абсолютно упругого — 0,5. Для большинства сталей этот коэффициент лежит в районе 0,3, для резины он примерно равен 0,5. (Измеряется в относительных единицах: мм/мм, м/м).
15. Работа газа в изопроцессах.
При расширении работа, совершаемая газом, положительна, при сжатии – отрицательна. В общем случае при переходе из некоторого начального состояния (1) в конечное состояние (2) работа газа выражается формулой:
|
или в пределе при ΔVi → 0:
|
В изохорном процессе (V = const) газ работы не совершает, A = 0.
В изобарном процессе (p = const) работа, совершаемая газом, выражается соотношением:
A = p (V2 – V1) = pΔV. |
В изотермическом процессе температура газа не изменяется, следовательно, не изменяется и внутренняя энергия газа, ΔU = 0.
Первый закон термодинамики для изотермического процесса выражается соотношением Q = A.
Количество теплоты Q, полученной газом в процессе изотермического расширения, превращается в работу над внешними телами. При изотермическом сжатии работа внешних сил, произведенная над газом, превращается в тепло, которое передается окружающим телам.
Наряду с изохорным, изобарным и изотермическим процессами в термодинамике часто рассматриваются процессы, протекающие в отсутствие теплообмена с окружающими телами. Сосуды с теплонепроницаемыми стенками называются адиабатическими оболочками, а процессы расширения или сжатия газа в таких сосудах называются адиабатическими.
Работа газа в адиабатическом процессе выражается через температуры T1 и T2 начального и конечного состояний:
A = CV (T2 – T1). |
16. Статический вес. Энтропия. III начало термодинамики.
Статистический вес, в квантовой механике и квантовой статистике — число различных квантовых состояний с данной энергией, то есть кратность состояния. Если энергия принимает непрерывный ряд значений, под Статистический вес понимают число состояний в данном интервале энергий. В классической статистике Статистический вес называют величину элемента фазового объёма системы.
Энтропи́я (от греч. ἐντροπία — поворот, превращение) в естественных науках — мера беспорядка системы, состоящей из многих элементов. В частности, в статистической физике — мера вероятности осуществления какого-либо макроскопического состояния.
Понятие энтропии впервые было введено Клаузиусом в термодинамике в 1865 году для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной при обратимых процессах, тогда как в необратимых — её изменение всегда положительно.
![]() ,
,
где dS — приращение энтропии; δQ — минимальная теплота, подведенная к системе; T — абсолютная температура процесса.
Третье начало термодинамики может быть сформулировано так:
«Приращение энтропии при абсолютном нуле температуры стремится к конечному пределу, не зависящему от того, в каком равновесном состоянии находится система».
![]()
или

где x — любой термодинамический параметр.
Третье начало термодинамики относится только к равновесным состояниям.
Поскольку на основе второго начала термодинамики энтропию можно определить только с точностью до произвольной аддитивной постоянной (то есть, определяется не сама энтропия, а только её изменение):
,
третье начало термодинамики может быть использовано для точного определения энтропии. При этом энтропию равновесной системы при абсолютном нуле температуры считают равной нулю.
Третье
начало термодинамики позволяет находить
абсолютное значение энтропии, что нельзя
сделать в рамках классической термодинамики
(на основе первого и второго начал
термодинамики). В классической
термодинамике энтропия может быть
определена лишь с точностью до произвольной
аддитивной постоянной S0,
что не мешает термодинамическим
исследованиям, так как реально измеряется
разность энтропий (S0) в
различных состояниях. Согласно третьему
началу термодинамики, при ![]() значение
значение ![]() .
.
В 1911
году Макс
Планк сформулировал
третье начало термодинамики, как условие
обращения в нуль энтропии всех тел при
стремлении температуры к абсолютному
нулю: ![]() .
Отсюда S0 =
0, что даёт возможность определять
абсолютное значения энтропии и
другихтермодинамических
потенциалов.
Формулировка Планка соответствует
определению энтропии в статистической
физике через термодинамическую
вероятность (W) состояния
системы S = kln W.
При абсолютном нуле температуры система
находится в основном квантово-механическом
состоянии. Если оно невырожденно, то W =
1 (состояние реализуется единственным
микрораспределением) и энтропия S при
равна
нулю. В действительности при всех
измерениях стремление энтропии к нулю
начинает проявляться значительно
раньше, чем могут стать существенными
дискретность квантовых уровней
макроскопической системы и влияние
квантового вырождения.
.
Отсюда S0 =
0, что даёт возможность определять
абсолютное значения энтропии и
другихтермодинамических
потенциалов.
Формулировка Планка соответствует
определению энтропии в статистической
физике через термодинамическую
вероятность (W) состояния
системы S = kln W.
При абсолютном нуле температуры система
находится в основном квантово-механическом
состоянии. Если оно невырожденно, то W =
1 (состояние реализуется единственным
микрораспределением) и энтропия S при
равна
нулю. В действительности при всех
измерениях стремление энтропии к нулю
начинает проявляться значительно
раньше, чем могут стать существенными
дискретность квантовых уровней
макроскопической системы и влияние
квантового вырождения.