Билет 16 Строение бензола Согласно теории резонанса, в любом случае, когда строение молекулы может быть изображено несколькими структурами, отличающимися только распределением электронов, ни одна из этих структур не адекватна рассматриваемой молекуле. Молекула представляет собой резонансный гибрид этих структур, называемых граничными. Каждая из граничных структур вносит свой вклад в гибрид: чем устойчивее структура, тем больше ее вклад.
Бензол представляет собой резонансный гибрид двух равноценных граничных структур: (I) и (II).
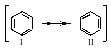
Изображение бензола в виде двух структур вовсе не предполагает их существование. Это означает, что строение бензола не может быть изображено ни структурой (I), ни структурой (II). Бензол имеет строение, промежуточное между ними. Поскольку граничные структуры (I) и (II) эквивалентны, их вклад в резонансную структуру одинаков. Бензол устойчивее, чем любая из граничных структур, на 154 кДж/моль.
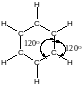
Каждый атом углерода в молекуле бензола находится в sp2-гибридном состоянии и связан тремя -связями с двумя атомами углерода и одним атомом водорода. Атомы углерода и водорода лежат в одной плоскости.
Ч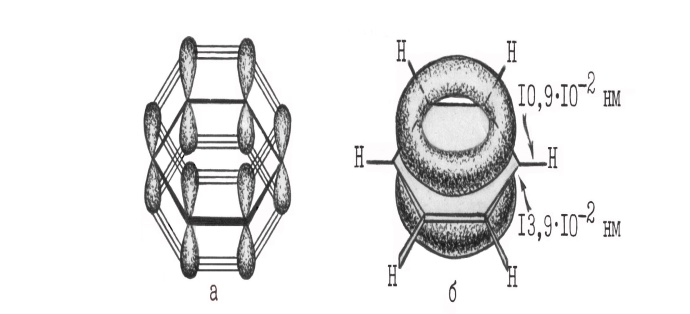 етвертый
валентный электрон атома углерода
находится на 2р-орбитали,
перпендикулярной плоскости молекулы.
Эти 2р-орбитали
состоят из двух одинаковых долей, одна
из которых лежит выше, другая - ниже
плоскости кольца; 2р-орбиталь
каждого атома углерода перекрывается
с 2р-орбиталями
обоих соседних атомов углерода. В
результате образуется замкнутая
шести--электронная
система в виде двух “бубликов”, один
из которых лежит выше, а другой - ниже
плоскости правильного шестиугольника.
Рис.
7.2. Молекула бензола:
етвертый
валентный электрон атома углерода
находится на 2р-орбитали,
перпендикулярной плоскости молекулы.
Эти 2р-орбитали
состоят из двух одинаковых долей, одна
из которых лежит выше, другая - ниже
плоскости кольца; 2р-орбиталь
каждого атома углерода перекрывается
с 2р-орбиталями
обоих соседних атомов углерода. В
результате образуется замкнутая
шести--электронная
система в виде двух “бубликов”, один
из которых лежит выше, а другой - ниже
плоскости правильного шестиугольника.
Рис.
7.2. Молекула бензола:
а - перекрывание 2р-орбиталей, образующих -связи;
б - -облака в виде двух "бубликов"
Благодаря коллективному взаимодействию всех шести -элек-тронов происходит выравнивание всех связей С–С по длине и кратности. Все связи углерод-углерод в молекуле бензола являются промежуточными между двойной и простой связями. Длина всех связей С–С в бензоле (13,910-2 нм) оказывается промежуточной между длиной двойной связи С=С в алкенах (13,410-2 нм) и расчётным значением длины простой связи С(sp2)–С(sp2), равным (14,810-2 нм).
Вторым следствием коллективного -электронного взаимодействия является выигрыш энергии за счет резонанса структур (I) и (II), т.е. электронная и связанная с ней термодинамическая и кинетическая стабилизация бензола.
Номенклатура. Широко используются тривиальные названия (толуол, ксилол, кумол и т.п.). Систематические названия строят из названия углеводородного радикала (приставка) и слова бензол (корень):
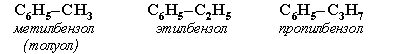
Если радикалов два или более, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Нумерацию кольца проводят так, чтобы номера радикалов были наименьшими. Например:
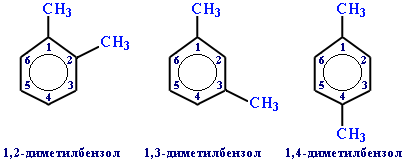
Для дизамещенных бензолов R-C6H4-R используется также и другой способ построения названий, при котором положение заместителей указывают перед тривиальным названием соединения приставками: орто- (о-) заместители у соседних атомов углерода кольца, т.е. 1,2-; мета- (м-) заместители через один атом углерода (1,3-); пара- (п-) заместители на противоположных сторонах кольца (1,4-).
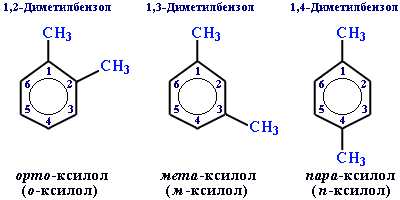
Ароматические одновалентные радикалы имеют общее название "арил". Из них наиболее распространены в номенклатуре органических соединений два: C6H5- (фенил) и C6H5CH2- (бензил).
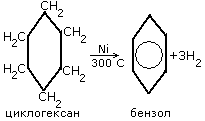
Методы получения аренов
1. Дегидрирование циклогексана
2.Тримеризация ацетилена
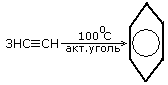
3.Выделение из нефти, каменноугольного дегтя
Химические свойства Для бензола характерны реакции замещения, в которых сохраняется устойчивая шести--электронная ароматическая система. Хотя -электроны ароматического кольца в большей степени, чем -электроны в алкенах, участвуют в связывании ядер углерода, они удерживаются все же слабее, чем - электроны, и доступны для реагентов, любящих электроны - электрофилов. Следовательно, типичными реакциями аренов должны быть реакции электрофильного замещения (SE Ar).
Электрофильное замещение Для аренов характерны следующие реакции электрофильного замещения
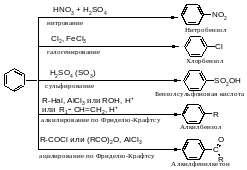
Нитрование Азотная кислота очень медленно реагирует с бензолом. Для ускорения реакции нитрования бензола к азотной кислоте добавляют серную кислоту. Смесь концентрированных серной и азотной кислот называют нитрующей смесью.
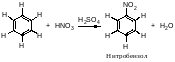
Образование электрофильной частицы - нитроний-катиона NO2 происходит в реакции между азотной и серной кислотами. Вначале образуется протонированная азотная кислота.
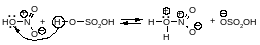
Эта реакция представляет собой кислотно-основное равновесие. Серная кислота является кислотой, а более слабая азотная кислота ведёт себя как основание, предоставляя пару электронов для образования связи с протоном. Протонированная азотная кислота распадается с образованием нитроний-катиона O2N и молекулы воды.
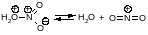
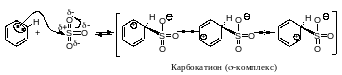
Первая стадия нитрования начинается атакой положительно заряженным нитроний-катионом доступного -электронного облака бензола с образованием -комплекса -К1 (рис. 7.3). Это комплекс между электрофилом и ароматическим субстратом, в котором ароматическое соединение выступает в роли донора электронов, а электрофил действует как акцептор электронов, при этом сохраняется сопряженная 6-электронная система. Атом азота не соединен с каким-либо одним атомом углерода.
Вторая стадия - медленная - электрофил вытягивает из 6-электронной системы пару электронов. За счёт этой пары электронов
-
Еп
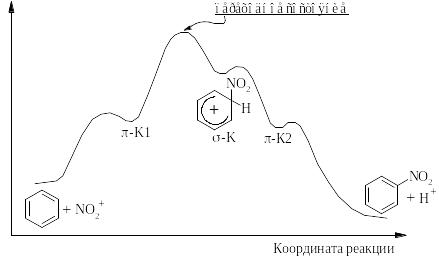
ГалогенированиеХлор и бром реагируют с бензолом в присутствии кислот Льюиса (AlCl3, FeCl3).

Электрофильная частица образуется в реакции галогена с катализатором. Эта реакция представляет собой кислотно-основное взаимодействие, продуктом которого является донорно-акцепторный комплекс (ДАК).
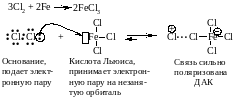
Внешний атом хлора становится достаточно электрононенасыщенным, чтобы атаковать бензольное ядро.
Стадия образования карбокатиона (-комплекса).
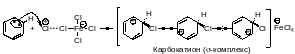
Стадия стабилизации -комплекса. Карбокатион теряет протон, восстанавливается ароматический секстет электронов.
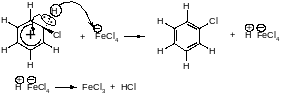
Благодаря регенерации хлорида железа для реакции необходимо лишь каталитическое количество FeCI3.
Благодаря регенерации хлорида железа для реакции необходимо лишь каталитическое количество FeCI3.
СульфированиеСульфирование бензола можно осуществить дымящей серной кислотой (Н2SО4+ SO3).
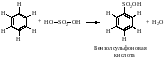
В этой реакции электрофильным реагентом является трёхокись серы SO3 - нейтральная молекула, в которой три электроотрицательных атома кислорода, связанные с атомом серы, делают последний электрононенасыщенным.
Стадия образования карбокатиона.
Стадия стабилизации карбокатиона. Карбокатион отдаёт протон с образованием аниона бензолсульфоновой кислоты.
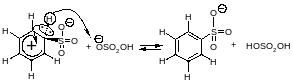
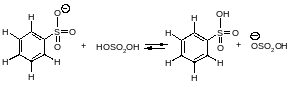
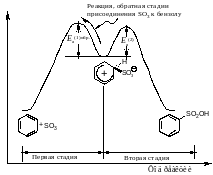
Каждая стадия реакции сульфирования обратима, поэтому и весь процесс является обратимым. Применение серной кислоты, богатой олеумом, сдвигает равновесие в сторону образования бензолсульфоновой кислоты.
Причина обратимости реакции сульфирования в том, что энергетические барьеры по обе стороны от -комплекса приблизительно одной высоты (рис. 7.5).
Еп |
|